
【题目】依次书写下列有关反应化学方程式或离子方程式,并指出某些反应的氧化剂。
(1)铁与水蒸气反应_________________________氧化剂_________________
(2)二氧化硅与碳在高温下反应_______________________________ 氧化剂_________
(3)硝酸银与氯化钠反应的离子方程式______________________
(4)粗盐提纯中与氯化钡反应的相关离子方程式_____________________________________
【答案】3Fe+4H2O![]() Fe3O4+4H2(g) H2O SiO2+2C
Fe3O4+4H2(g) H2O SiO2+2C![]() Si+2CO↑ SiO2 Ag++Cl﹣=AgCl↓ Ba2++CO32-=BaCO3↓、Ba2++SO42-=BaSO4↓
Si+2CO↑ SiO2 Ag++Cl﹣=AgCl↓ Ba2++CO32-=BaCO3↓、Ba2++SO42-=BaSO4↓
【解析】
(1)铁与水蒸气反应生成氢气和四氧化三铁,元素化合价降低的是氧化剂;
(2)二氧化硅与碳在高温下反应生成CO和硅单质,元素化合价降低的是氧化剂;
(3)硝酸银与氯化钠反应生成氯化银和硝酸钠;
(4)粗盐提纯中加入氯化钡为了除去硫酸根离子;过量的氯化钡需要用碳酸钠除去。
(1)铁与水蒸气反应生成氢气和四氧化三铁,方程式为3Fe+4H2O![]() Fe3O4+4H2(g),该反应中H元素化合价降低,故氧化剂是H2O;
Fe3O4+4H2(g),该反应中H元素化合价降低,故氧化剂是H2O;
(2)二氧化硅与碳在高温下反应生成CO和硅单质,方程式为SiO2+2C![]() Si+2CO↑,该反应中Si元素化合价降低,故氧化剂是SiO2;
Si+2CO↑,该反应中Si元素化合价降低,故氧化剂是SiO2;
(3)硝酸银与氯化钠反应生成氯化银和硝酸钠,方程式为AgNO3+NaCl=AgCl![]() +NaNO3,离子方程式为Ag++Cl﹣=AgCl↓;
+NaNO3,离子方程式为Ag++Cl﹣=AgCl↓;
(4)粗盐提纯中加入氯化钡为了除去硫酸根离子,离子方程式为:Ba2++SO42-=BaSO4↓;过量的氯化钡需要用碳酸钠除去,离子方程式为:Ba2++CO32-=BaCO3↓。


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】碘及其化合物在科研、生活等方面有广泛用途。如图所示为从海带中制取碘的工艺流程。

已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
请回答下列问题:
(1)分液漏斗使用前需要检漏,检漏方法为__________。
(2)步骤X中,萃取后分液漏斗内观察到的现象是_____________。
(3)下列有关步骤Y的说法中正确的是_____(填字母)。
A.应控制NaOH溶液的浓度和体积
B.将碘单质转化成碘离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以用乙醇代替
(4)向“上层”中加入H2SO4溶液,发生反应的化学方程式为____,操作Z的名称为________。
(5)方案甲中采用蒸馏不合理,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4超干重整CO2技术可得到富含CO的化工原料。回答下列问题:
(1)CH4超干重整CO2的催化转化如图所示:
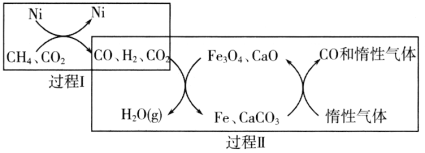
①已知相关反应的能量变化如图所示:

过程Ⅰ的热化学方程式为________。
②关于上述过程Ⅱ的说法不正确的是________(填序号)。
a.实现了含碳物质与含氢物质的分离
b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应
d.Fe3O4、CaO为催化剂,降低了反应的ΔH
③其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应CH4(g)+CO2(g)=2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态________(填“是”或“不是”)平衡状态;b点CH4的转化率高于c点,原因是________。
(2)在一刚性密闭容器中,CH4和CO2的分压分别为20kPa、25kPa,加入Ni/α-Al2O3催化剂并加热至1123K使其发生反应CH4(g)+CO2(g)=2CO(g)+2H2(g)。

①研究表明CO的生成速率υ(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,某时刻测得p(CO)=20kPa,则p(CO2)=________kPa,υ(CO)=________mol·g-1·s-1。
②达到平衡后测得体系压强是起始时的1.8倍,则该反应的平衡常数的计算式为Kp=________(kPa)2。(用各物质的分压代替物质的量浓度计算)
(3)CH4超干重整CO2得到的CO经偶联反应可制得草酸(H2C2O4)。常温下,向某浓度的草酸溶液中加入一定浓度的NaOH溶液,所得溶液中![]() ,则此时溶液的pH=________。(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)
,则此时溶液的pH=________。(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)某同学帮助水质检测站配制480 mL 0.5 mol·L-1NaOH溶液以备使用。
(1)该同学应选择________mL的容量瓶。
(2)其操作步骤如下图所示,
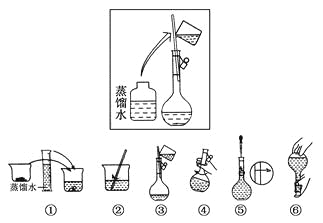
则如图操作应在下图中的________(填选项字母)之间。
A.②与③ B.①与② C.④与⑤
(3)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小________(填字母),并在下图中选出能正确表示游码位置的选项________(填字母)。
附表 砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
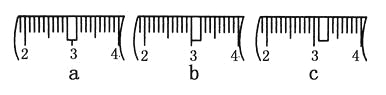
(4)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会________(填“偏大”、“偏小”或“无影响”,下同)
②容量瓶中原来有少量蒸馏水,浓度会________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3A(g)+B(g)![]() 2C(g)+2D(s)在2 L密闭容器中进行,经过4min,B减少了0.4 mol,则0~4min内此反应的平均速率为
2C(g)+2D(s)在2 L密闭容器中进行,经过4min,B减少了0.4 mol,则0~4min内此反应的平均速率为
A. v(A)=0.15 mol·L1B. v(B)=0.05 mol·L1·s1
C. v(C)=0.10 mol·L1·min1D. v(D)=0.10 mol·L1·min1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 某可逆反应在某体积为2L的密闭容器中进行,在从0~3min各物质的量的变化情况如图所示(A、B、C均为气体)
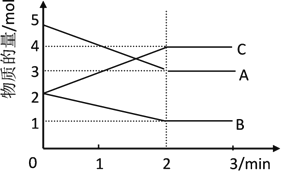
(1)该反应的化学方程式为______
(2)反应开始至2min时,B的平均反应速率为______
(3)能说明该反应已达到平衡状态的是______
A. c(A)= c(B)= c(C) B. 容器内压强保持不变 C . v逆(A)= v正(C) D. c(C)不再变化
(4)由图求得A的平衡时的转化率为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏德罗常数,下列叙述正确的是( )
A. 标准状况下,22.4L H2O含有的分子数为 NA
B. 通常状况下,NA 个CO2分子占有的体积为22.4L
C. 物质的量浓度为1mol/L的MgCl2溶液中,含有Cl—个数为2NA
D. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是
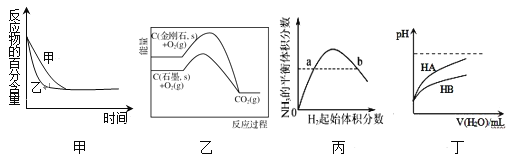
A.图甲表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
B.图乙是金刚石与石墨分别氧化生成CO2的能量关系曲线,说明石墨转化为金刚石的反应的ΔH>0
C.图丙表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率大于b点
D.图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物N(![]() )是一种常见的有机合成中间体,在生产中用途广泛。
)是一种常见的有机合成中间体,在生产中用途广泛。
有机物A为原料合成M和N的路线如下所示:

已知:I.R-CH=CH2+HBr ![]() R-CH2CH2Br
R-CH2CH2Br
II.R-CH2-CN![]() R-CH2-COOH
R-CH2-COOH ![]()
![]()
请回答下列问题:
(1)A分子中共面的原子数最多为___________个,-CN的电子式为___________。
(2)②的反应类型为___________,E分子中所含官能团的名称为___________,G的结构简式为______________________。
(3)写出反应⑤的化学方程式__________________________。
(4)写出M在酸性条件下水解的化学方程式______________________。
(5)D的同分异构体中,能发生银镜反应,且能与钠反应放出H2的共有___________种,写出核磁共振氢谱有4组峰,且峰面积比为1:1:2:6的一种同分异构体的结构简式:___________。
(6)结合信息,写出用E和乙醇为原料制备化合物N的合成路线:(其他试剂任选)___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com