
【题目】铝土矿(主要成分为Al2O3,还含有SiO2(不溶于水和酸)、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
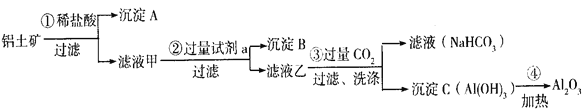
(1)沉淀A、B的成分分别是__________、__________;步骤②中的试剂a是__________;(以上均填化学式)
(2)试写出步骤③中发生反应的离子方式__________、__________;
【答案】SiO2 Fe(OH)3 NaOH溶液 CO2 +OH- =HCO3- CO2 +AlO2- +2H2O=Al(OH)3 ↓+HCO3-
【解析】
铝土矿中加入过量试剂盐酸,然后过滤得到沉淀A为SiO2,滤液甲中加入过量NaOH溶液过滤后得到沉淀B和滤液乙,滤液甲中溶质为氯化铝和氯化铁、HCl,沉淀B为Fe(OH)3,滤液乙中含有NaAlO2和NaOH、NaCl,向滤液乙中通入过滤二氧化碳得到滤液碳酸氢钠溶液,沉淀C为Al(OH)3,加热氢氧化铝得到氧化铝,以此解答该题。
(1)由以上分析可知A为SiO2,沉淀B为Fe(OH)3,滤液甲中含有Al3+、Fe3+、H+等,应加入氢氧化钠,除去铁离子,将铝离子转化为AlO2-,步骤②中的试剂a是NaOH溶液;
(2)步骤③中与OH-反应生成碳酸氢根离子:CO2+OH-=HCO3-,偏铝酸钠溶液与二氧化碳反应,生成氢氧化铝和碳酸氢钠,离子反应为:CO2 +AlO2- +2H2O=Al(OH)3↓+HCO3-。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】为探究Na2SO3 溶液和铬(VI)盐溶液的反应规律,某小组同学进行实验如下: 已知:![]() (橙色)+ H2O
(橙色)+ H2O![]() (黄色)+ 2H+
(黄色)+ 2H+
(1)配制溶液
序号 | 操作 | 现象 |
i | 配制饱和Na2SO3 溶液,测溶液的pH | pH 约为 9 |
ii | 配制0.05 mol·L1 的K2Cr2O7溶液,把溶液平均分成两份,向两份溶液中分别滴加浓硫酸和浓 KOH 溶液,得到pH=2 的溶液A 和 pH=8 的溶液B | pH=2的溶液A 呈橙色;pH=8的溶液 B 呈黄色 |
① 用化学用语表示饱和 Na2SO3 溶液 pH 约为 9 的原因:__。
(2)进行实验iii 和 iv:
序号 | 操作 | 现象 |
iii | 向 2 mL 溶液 A 中滴加 3 滴饱和 Na2SO3 溶液 | 溶液变绿色(含Cr3+) |
iv | 向 2 mL 溶液 B 中滴加 3 滴饱和 Na2SO3 溶液 | 溶液没有明显变化 |
② 用离子方程式解释 iii 中现象:__。
(3)继续进行实验v:
序号 | 操作 | 现象 |
v | 向 2 mL 饱和 Na2SO3 溶液中滴加 3 滴溶液A | 溶液变黄色 |
vi | 向 2 mL 蒸馏水中滴加 3 滴溶液A | 溶液变浅橙色 |
③ 实验 vi 的目的是__。
④ 用化学平衡移动原理解释 v 中现象:__。
⑤ 根据实验iii~v,可推测:Na2SO3 溶液和铬(VI)盐溶液的反应与溶液酸碱性有关,__。
⑥ 向实验 v 所得黄色溶液中滴加__,产生的现象证实了上述推测。
(4)继续探究溶液酸性增强对铬(VI)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
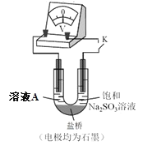
a.K 闭合时,电压为a。
b.向U 型管左侧溶液中滴加 3 滴浓硫酸后,电压增大了b。
⑦ 上述实验说明:__。
⑧ 有同学认为:随溶液酸性增强,溶液中O2 的氧化性增强也会使电压增大。利用如图装置选择合适试剂进行实验,结果表明O2 的存在不影响上述结论。该实验方案是__,测得电压增大了 d(d < b)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
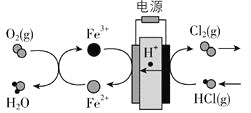
负极区发生的反应有_________![]() 写反应方程式
写反应方程式![]() 。电路中转移
。电路中转移![]() 电子,需消耗氧气__________
电子,需消耗氧气__________![]() 标准状况
标准状况![]() 。
。
![]() 电解法转化
电解法转化![]() 可实现
可实现![]() 资源化利用。电解
资源化利用。电解![]() 制HCOOH的原理示意图如下。
制HCOOH的原理示意图如下。

![]() 写出阴极
写出阴极![]() 还原为
还原为![]() 的电极反应式:________。
的电极反应式:________。
![]() 电解一段时间后,阳极区的
电解一段时间后,阳极区的![]() 溶液浓度降低,其原因是_____。
溶液浓度降低,其原因是_____。
![]() 可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接
可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接![]() 或
或![]() ,可交替得到
,可交替得到![]() 和
和![]() 。
。
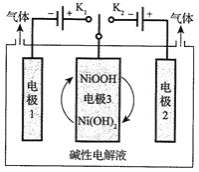
![]() 制
制![]() 时,连接_______________。产生
时,连接_______________。产生![]() 的电极反应式是_________。
的电极反应式是_________。
![]() 改变开关连接方式,可得
改变开关连接方式,可得![]() 。
。
![]() 结合
结合![]() 和
和![]() 中电极3的电极反应式,说明电极3的作用:___________。
中电极3的电极反应式,说明电极3的作用:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
![]() 已知:
已知:![]() ,则反应
,则反应![]() ______ 。
______ 。
![]() 天然气的一个重要用途是制取
天然气的一个重要用途是制取![]() ,其原理为:
,其原理为:![]() 。一定条件下,在密闭容器中,通入物质的量浓度均为
。一定条件下,在密闭容器中,通入物质的量浓度均为![]() 的
的![]() 与
与![]() ,在发生反应时,测得
,在发生反应时,测得![]() 的平衡转化率与温度及压强的关系如图1所示,
的平衡转化率与温度及压强的关系如图1所示,
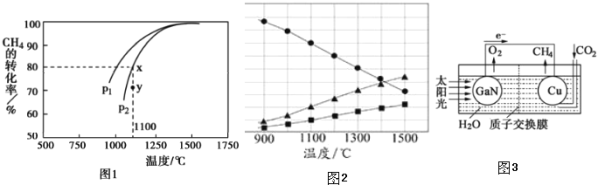
![]() 该反应的平衡常数表达式为______ 。
该反应的平衡常数表达式为______ 。
![]() 压强
压强![]() ______
______ ![]() 填“大于”或“小于”
填“大于”或“小于”![]() ;压强为
;压强为![]() 时,在Y点:
时,在Y点:![]() 正
正![]() ______
______ ![]() 逆
逆![]() 填“大于“、“小于”或“等于“
填“大于“、“小于”或“等于“![]() 。
。
![]() 天然气中的少量
天然气中的少量![]() 杂质常用氨水吸收,产物为
杂质常用氨水吸收,产物为![]() 。一定条件下向
。一定条件下向![]() 溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为______ 。
溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为______ 。
![]() 工业上又常将从天然气分离出的
工业上又常将从天然气分离出的![]() ,在高温下分解生成硫蒸气和
,在高温下分解生成硫蒸气和![]() ,若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图2所示,
,若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图2所示,![]() 在高温下分解反应的化学方程式为______ 。
在高温下分解反应的化学方程式为______ 。
![]() 科学家用氮化镓材料与铜组装如图3的人工光合系统,利用该装置成功地实现了以
科学家用氮化镓材料与铜组装如图3的人工光合系统,利用该装置成功地实现了以![]() 和
和![]() 合成
合成![]() 。
。
![]() 写出铜电极表面的电极反应式为______ 。
写出铜电极表面的电极反应式为______ 。
![]() 为提高该人工光合系统的工作效率,可向装置中加入少量______
为提高该人工光合系统的工作效率,可向装置中加入少量______ ![]() 选填“盐酸”或“硫酸”
选填“盐酸”或“硫酸”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洗煤和选煤过程中排出的煤矸石(主要含Al2O3、SiO2及Fe2O3)会占用大片土地,造成环境污染。某课题组利用煤矸石制备聚合氯化铝流程如下:
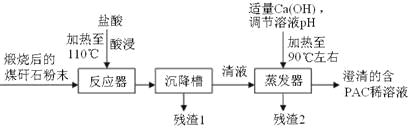
已知:聚合氯化铝([Al2(OH)nCl6-n]m(1≤n≤5,m≤10),商业代号PAC)是一种新型、高效絮凝剂和净水剂。
(1)酸浸的目的是___________________________;实验需要的500mL3.0 mol·L-1的盐酸,配制时所需要的玻璃仪器除量筒、烧杯、玻璃棒外还有______________________。
(2)若m=n=2,则生成PAC的化学方程式是_____________________。
(3)从含PAC的稀溶液中获得PAC固体的实验操作方法是_______、_________、_________。
(4)为了分析残渣2中铁元素的含量,某同学称取5.000g残渣2,先将其预处理使铁元素还原为Fe2+,并在容量瓶中配制成100mL溶液;然后移取25.00mL试样溶液,用1.000×10-2mol·L-1KMnO4标准溶液滴定,消耗标准溶液20.00mL。已知反应式为Fe2++MnO4-+H+—Fe3++Mn2++H2O(未配平)。判断滴定终点的依据是_______________________;残渣2中铁元素的质量分数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O35H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定型剂,也可用于纸浆漂白作脱氧剂,它易溶于水,难溶于乙醇,加热、遇酸均易分解,工业上常用亚硫酸钠法、硫化碱法等制备,某实验模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
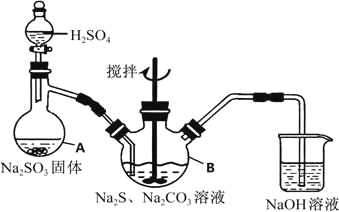
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体均匀的通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸
②直至析出的浑浊不再消失,并控制溶液的PH接近7时,停止通入SO2气体
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O35H2O
④在经过滤、洗涤、干燥.得到所需产品
(1)写出仪器A的名称_____________,步骤④中洗涤时,为了减少产物的损失的试剂可以是_______
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液PH<7,请用离子方程式解释原因_____________
(3)最后得到的产品可能含有反应Na2SO4杂质,请设计实验检测产品中是否存在Na2SO4(已知BaS2O3不溶于水),简要说明实验操作.现象和结论_____________
(4)测定产品纯度
①准确称取1.00g产品,用适量蒸馏水溶解,以淀粉作指示剂用0.1000molL﹣1碘的标准溶液滴定,反应原理为2S2O32﹣+I2=S4O32﹣+2I﹣,滴定起始和终点的滴定管液面位置如图则消耗碘的标准溶液体积为_______mL,产品的纯度为_______%
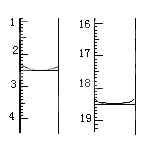
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O35H2O的质量分数的测量结果________(填“偏高”“偏低”或“不变”)。
(5)Na2S2O3常用于脱氧剂,在溶液易被Cl2氧化SO42﹣,该反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚磷酸![]() 是二元酸,
是二元酸,![]() 溶液存在电离平衡:
溶液存在电离平衡:![]() 亚磷酸与足量NaOH溶液反应,生成
亚磷酸与足量NaOH溶液反应,生成![]() .
.

![]() 写出亚磷酸与少量NaOH溶液反应的离子方程式 _______________;
写出亚磷酸与少量NaOH溶液反应的离子方程式 _______________;
![]() 某温度下,
某温度下,![]() 的
的![]() 溶液pH的读数为
溶液pH的读数为![]() ,即此时溶液中
,即此时溶液中![]() ,除
,除![]() 之外其他离子的浓度由小到大的顺序是 _____________,该温度下
之外其他离子的浓度由小到大的顺序是 _____________,该温度下![]() 电离平衡的平衡常数
电离平衡的平衡常数![]() ___________。
___________。![]() 第二步电离忽略不计,结果保留两位有效数字
第二步电离忽略不计,结果保留两位有效数字![]()
![]() 向
向![]() 溶液中滴加NaOH溶液至中性,所得溶液中
溶液中滴加NaOH溶液至中性,所得溶液中![]() ___________
___________ ![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() .
.
![]() 亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式 _____________;
亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式 _____________;
![]() 电解
电解![]() 溶液也可得到亚磷酸,装置示意图如图:说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
溶液也可得到亚磷酸,装置示意图如图:说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
![]() 阴极的电极反应式为 ________________;
阴极的电极反应式为 ________________;
![]() 产品室中反应的离子方程式为 ______________。
产品室中反应的离子方程式为 ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3+5O2![]() 4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则下列反应速率正确的是( )
4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则下列反应速率正确的是( )
A.v(NH3)=0.002mol·L-1·s-1B. v(NO)=0.008mol·L-1·s-1
C. v(H2O)=0.015mol·L-1·s-1D. v(O2)=0.01mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有浓度都为0.1mol·L-1HA、HB的溶液各20mL,分别用0.1mol·L-1NaOH溶液滴定。溶液的pH与加入NaOH溶液体积V的关系如图所示。下列判断错误的是
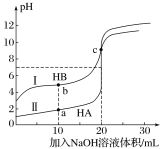
A. 滴定过程中,水电离的c(H+)·c(OH-)均不变
B. 相同条件下,HB的电离程度小于HA的电离程度
C. V=10mL时,c(HB)+c(B-)=2c(Na+)
D. V=20mL时,c(A-)>c(B-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com