
【题目】![]() 在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
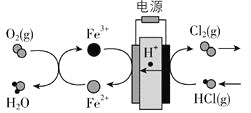
负极区发生的反应有_________![]() 写反应方程式
写反应方程式![]() 。电路中转移
。电路中转移![]() 电子,需消耗氧气__________
电子,需消耗氧气__________![]() 标准状况
标准状况![]() 。
。
![]() 电解法转化
电解法转化![]() 可实现
可实现![]() 资源化利用。电解
资源化利用。电解![]() 制HCOOH的原理示意图如下。
制HCOOH的原理示意图如下。

![]() 写出阴极
写出阴极![]() 还原为
还原为![]() 的电极反应式:________。
的电极反应式:________。
![]() 电解一段时间后,阳极区的
电解一段时间后,阳极区的![]() 溶液浓度降低,其原因是_____。
溶液浓度降低,其原因是_____。
![]() 可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接
可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接![]() 或
或![]() ,可交替得到
,可交替得到![]() 和
和![]() 。
。
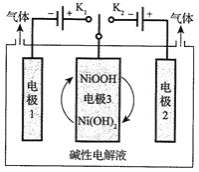
![]() 制
制![]() 时,连接_______________。产生
时,连接_______________。产生![]() 的电极反应式是_________。
的电极反应式是_________。
![]() 改变开关连接方式,可得
改变开关连接方式,可得![]() 。
。
![]() 结合
结合![]() 和
和![]() 中电极3的电极反应式,说明电极3的作用:___________。
中电极3的电极反应式,说明电极3的作用:___________。
【答案】![]() 、
、![]()
![]()
![]() 或
或![]() 阳极产生
阳极产生![]() ,pH减小,
,pH减小,![]() 浓度降低,
浓度降低,![]() 部分迁移至阴极区
部分迁移至阴极区 ![]()
![]() 制
制![]() 时,电极3发生反应:
时,电极3发生反应:![]() ,制
,制![]() 时,上述电极反应逆向进行,使电极3得以循环使用
时,上述电极反应逆向进行,使电极3得以循环使用
【解析】
(1)据图像知负极区即阴极区发生还原反应,根据电子守恒规律计算产生气体的量;(2)根据电解原理,判断阴极上得到电子,发生还原反应,阳极上失电子发生氧化反应。(3)氢气在阴极产生,氧气在阳极生成。电极3的Ni(OH)2和NiOOH在制氢气和氧气时相互转化,可以循环利用。
![]() 据图像知负极区即阴极区发生还原反应,电极反应为
据图像知负极区即阴极区发生还原反应,电极反应为![]() ,氧气再将亚铁离子氧化为铁离子,反应为
,氧气再将亚铁离子氧化为铁离子,反应为![]() ;电路中转移
;电路中转移![]() 电子,生成
电子,生成![]() ,需消耗氧气
,需消耗氧气![]() ,故答案为:
,故答案为:![]() 、
、![]() ;
;![]() ;
;
![]() 根据电解原理,阴极上得到电子,发生还原反应,电极反应式为
根据电解原理,阴极上得到电子,发生还原反应,电极反应式为![]() 或
或![]() ;
;
![]() 阳极反应式为
阳极反应式为![]() ,阳极附近pH减小,
,阳极附近pH减小,![]() 与
与![]() 反应,同时部分
反应,同时部分![]() 迁移至阴极区,所以电解一段时间后,阳极区的
迁移至阴极区,所以电解一段时间后,阳极区的![]() 溶液浓度降低;
溶液浓度降低;
故答案为:![]() 或
或![]() ;阳极产生
;阳极产生![]() ,pH减小,
,pH减小,![]() 浓度降低,
浓度降低,![]() 部分迁移至阴极区;
部分迁移至阴极区;
![]() 生成
生成![]() 时,根据电极放电规律可知
时,根据电极放电规律可知![]() 得到电子变为氢气,因而电极须连接电源负极,因而制
得到电子变为氢气,因而电极须连接电源负极,因而制![]() 时,连接
时,连接![]() ,该电池在碱性溶液中,电极反应式为
,该电池在碱性溶液中,电极反应式为![]() ;
;
![]() 电极3上NiOOH和
电极3上NiOOH和![]() 相互转化,当连接
相互转化,当连接![]() 时制
时制![]() ,
,![]() 失去电子变为NiOOH,当连接
失去电子变为NiOOH,当连接![]() 时制
时制![]() ,NiOOH得到电子变为
,NiOOH得到电子变为![]() ,其反应式为
,其反应式为![]()
![]()
![]() ,因而作用是连接
,因而作用是连接![]() 或
或![]() 时,电极3分别作为阳极材料和阴极材料,NiOOH和
时,电极3分别作为阳极材料和阴极材料,NiOOH和![]() 相互转化,故答案为:
相互转化,故答案为:![]() ;
;![]() ;
;
![]() 制
制![]() 时,电极3发生反应:
时,电极3发生反应:![]() ,制
,制![]() 时,上述电极反应逆向进行,使电极3得以循环使用。
时,上述电极反应逆向进行,使电极3得以循环使用。


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】500 ℃、20 MPa时,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3的物质的量变化如下图所示,下列说法中正确的是( )

A.从反应开始到第一次平衡时,N2的平均反应速率为0.005 mol·L-1·min-1
B.平衡在10 min至20 min的变化,可能是因为增大了容器体积
C.25 min时,分离出了0.1 mol NH3
D.在25 min后平衡向正反应方向移动,新平衡中NH3的体积分数比原平衡的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与盐的水解有关的是
① ![]() 与
与 ![]() 溶液可作焊接金属中的除锈剂 ②用
溶液可作焊接金属中的除锈剂 ②用 ![]() 与
与 ![]() 两种溶液可作泡沫灭火剂 ③草木灰与铵态氮肥不能混合施用 ④实验室盛放
两种溶液可作泡沫灭火剂 ③草木灰与铵态氮肥不能混合施用 ④实验室盛放 ![]() 溶液的试剂瓶不能用磨口玻璃塞
溶液的试剂瓶不能用磨口玻璃塞
A.①②③B.②③④C.①④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属保护的说法不正确的是 ( )
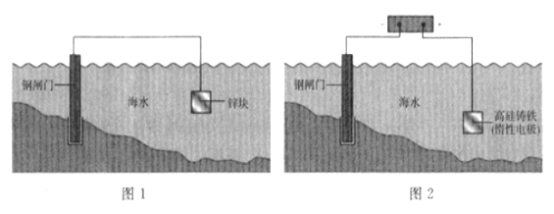
A. 图1是牺牲阳极阴极保护法,图2是外加电流阴极保护法
B. 钢闸门均为电子输入的一端
C. 锌和高硅铸铁的电板反应均为氧化反应
D. 两图所示原理均发生了反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,用![]() 滴定
滴定![]() 某一元酸HX,滴定过程中pH变化曲线如图所示。
某一元酸HX,滴定过程中pH变化曲线如图所示。

下列说法正确的是
A. HX溶液显酸性的原因是![]()
B. 点a,![]()
C. 点b,![]() 与
与![]() 恰好完全反应
恰好完全反应
D. 点c,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:氯酸钾能氧化Ag、Zn等金属。从一种银矿![]() 含Ag、Zn、Cu、Pb及少量
含Ag、Zn、Cu、Pb及少量![]() 中提取Ag、Cu及Pb的工艺流程如下:
中提取Ag、Cu及Pb的工艺流程如下:
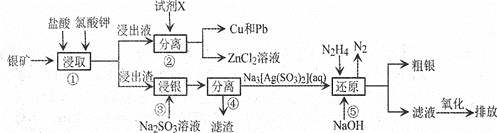
![]() 步骤
步骤![]() 提高矿物中金属离子浸取率除可改变盐酸的浓度和氯酸钾的量,还可采取的措施是________
提高矿物中金属离子浸取率除可改变盐酸的浓度和氯酸钾的量,还可采取的措施是________![]() 写出两种即可
写出两种即可![]() 。
。
![]() 步骤
步骤![]() 试剂X为________
试剂X为________![]() 填化学式,下同
填化学式,下同![]() ;步骤
;步骤![]() 滤渣的成分为________。
滤渣的成分为________。
![]() 步骤
步骤![]() 发生反应的化学方程式为________。
发生反应的化学方程式为________。
![]() 步骤
步骤![]() 发生反应的离子方程式为________;其中
发生反应的离子方程式为________;其中![]() 肼
肼![]() 的电子式为________。
的电子式为________。
![]() 还原后的“滤液”经氧化后,其中的溶质为________。
还原后的“滤液”经氧化后,其中的溶质为________。
![]() 粗银常用电解精炼法提纯,用粗银作阳极,银片作阴极,硝酸银和稀硝酸的混合溶液作电解液,在阴极上有无色气体产生,在液面上方变为红棕色。电解时阴极发生的电极反应为________。
粗银常用电解精炼法提纯,用粗银作阳极,银片作阴极,硝酸银和稀硝酸的混合溶液作电解液,在阴极上有无色气体产生,在液面上方变为红棕色。电解时阴极发生的电极反应为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究乙烯与溴的加成反应,甲同学设计并进行如下实验:先取一定量的工业用乙烯气体(在储气瓶中),使气体通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应;乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊物质,推测在工业上制得的乙烯中还可能含有少量还原性气体杂质,由此他提出必须先除去杂质,再让乙烯与溴水反应。请回答下列问题:
(1)甲同学设计的实验________(填“能”或“不能”)验证乙烯与溴发生了加成反应,其理由是________(填序号)。
①使溴水褪色的反应不一定是加成反应
②使溴水褪色的反应就是加成反应
③使溴水褪色的物质不一定是乙烯
④使溴水褪色的物质就是乙烯
(2)乙同学推测此乙烯中一定含有的一种杂质气体是________,它与溴水反应的化学方程式是________________。在实验前必须全部除去,除去该杂质的试剂可用________。
(3)为验证乙烯与溴发生的反应是加成反应而不是取代反应,丙同学提出可用![]() 试纸来测试反应后溶液的酸性,理由是_____________________________________________________________________________。
试纸来测试反应后溶液的酸性,理由是_____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2(不溶于水和酸)、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
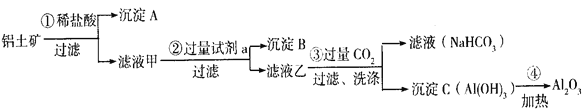
(1)沉淀A、B的成分分别是__________、__________;步骤②中的试剂a是__________;(以上均填化学式)
(2)试写出步骤③中发生反应的离子方式__________、__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素的单质和化合物很多,利用所学物质结构与性质的知识去认识和理解它们。
(1)溴的核外电子排布式为__。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在。使氢氟酸分子缔合作用力是___。
(3)下列曲线表示卤族元素某种性质随核电荷数递增的变化趋势,正确的是___。

(4)已知高碘酸有两种形式,化学式分别为H5IO6(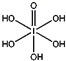 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6___HIO4(填“>”、“<”或“=”)。IO
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6___HIO4(填“>”、“<”或“=”)。IO![]() 的VSEPR模型为__。
的VSEPR模型为__。
(5)铜与氯形成化合物的晶胞如附图所示(黑点代表铜粒子)。

①该晶体的化学式为__。
②一定条件下,Cu2O比CuO更稳定的原因是__。
③已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体的边长为__pm。(用含ρ、NA的式子表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com