
(共14分)(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0 B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应为 。
(3)电解原理在化学工业中有着广泛的应用。
现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和
Y是两块电极板,则:
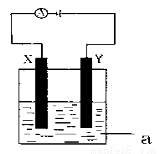
①若X和Y均为惰性电极,a为CuSO4
溶液,则电解时的化学反应方程式为 。
通电一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为 。
③若X、Y都是惰性电极,a是饱和NaCl溶液,则Y极的电极反应式为 ,
检验该电极反应产物的方法是 。
⑴ C ⑵H2 - 2e- +2OH- =2H2O
⑶ ① 2CuSO4+2H2O 2Cu+O2↑+2H2SO4 ;0.4mol ;② Cu - 2e- = Cu2+
2Cu+O2↑+2H2SO4 ;0.4mol ;② Cu - 2e- = Cu2+
③ 2Cl - - 2e - = Cl2 ↑;把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色则有Cl2生成。
【解析】
试题分析:化学反应若能设计为原电池吗,则应该满足:一是氧化还原反应,二是放热反应。对选项进行分析可知:只有C符合题意;(2)以KOH溶液为电解质溶液,将反应2H2(g)+O2(g)=2H2O(1) △H<0设计一个原电池,其负极是氢气,电极反应为H2 - 2e- +2OH- =2H2O;(3)①若X和Y均为惰性电极,a为CuSO4溶液,则应该是溶液中的离子放电,电解时的化学反应方程式为2CuSO4+2H2O 2Cu+O2↑+2H2SO4 ;通电一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的浓度和pH,则相当于反应发生产生了0.2mol的Cu和0.1mol的O2;则电解过程中转移的电子的物质的量为0.2×2mol=0.4mol。②若X、Y分别为铁和铜,a仍为CuSO4溶液,则阳极Y极的电极反应式为Cu - 2e- = Cu2+;③若X、Y都是惰性电极,a是饱和NaCl溶液,则是溶液中的阴离子Cl-放电,阳极Y极的电极反应式为2Cl - - 2e - = Cl2 ↑;检验该电极反应产物的方法是利用氯气的氧化性,把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色则有Cl2生成。
2Cu+O2↑+2H2SO4 ;通电一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的浓度和pH,则相当于反应发生产生了0.2mol的Cu和0.1mol的O2;则电解过程中转移的电子的物质的量为0.2×2mol=0.4mol。②若X、Y分别为铁和铜,a仍为CuSO4溶液,则阳极Y极的电极反应式为Cu - 2e- = Cu2+;③若X、Y都是惰性电极,a是饱和NaCl溶液,则是溶液中的阴离子Cl-放电,阳极Y极的电极反应式为2Cl - - 2e - = Cl2 ↑;检验该电极反应产物的方法是利用氯气的氧化性,把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色则有Cl2生成。
考点:考查原电池的构成原理、电解池原理、电极反应、物质的检验方法的知识。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源:2013~2014学年福建省第一学期高三第二次月考化学试卷(解析版) 题型:填空题
(15分)五种短周期元素A、B、C、D、E原子序数依次增大,结合下列信息:
(1)A原子核外电子总数是内层电子数的三倍,A、E同主族
(2)B的最高价氧化物对应的水化物F与其气态氢化物G反应,得到离子化合物H。
(3)C的焰色应呈黄色。
(4)D在同周期主族元素形成的简单离子中,离子半径最小.
回答下列问题:
(1)写出D在元素周期表中的位置:
(2)化合物H的水溶液pH 7 其原因是 (用离子方程式表示)
(3)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他四种物质发生化学反应,写出该物质的电子式
(4)某同学设计实验证明A、B、E的非金属性强弱关系。
①溶液a和b分别为 , 。
②溶液c中的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
工业上冶炼金属钼的化学原理为:
①2MoS2+7O2 2MoO3+4SO2;
2MoO3+4SO2;
②MoO3+2NH3·H2O = (NH4)2MoO4+H2O;
③(NH4)2MoO4+2HCl = H2MoO4↓+2NH4Cl;
④H2MoO4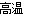 MoO3+H2O;
MoO3+H2O;
⑤用还原剂将MoO3还原成金属钼。则下列说法正确的是
A.上述①③⑤属于氧化还原反应,②④属于非氧化还原反应
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和Al分别还原等量的MoO3,所消耗还原剂的物质的量之比为3∶3∶2
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省鞍山市高一下学期期末考试化学(A卷)试卷(解析版) 题型:选择题
关于下图所示的原电池,下列说法错误的是

A.Cu为正极,Zn为负极
B.该装置能将化学能转化为电能
C.电子由铜片通过导线流向锌片
D.正极反应为:2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省抚顺市六校联合体高一下学期期末考试化学试卷(解析版) 题型:选择题
反应N2O4(g)  2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是( )
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是( )
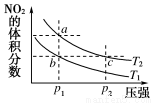
A.a 、c两点的反应速率:a>c B.a 、c两点气体的颜色:a深、c浅
C.由状态b到状态a ,可以用加热的方法 D.a 、c两点气体的平均相对分子质量:a>c
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省抚顺市六校联合体高一下学期期末考试化学试卷(解析版) 题型:选择题
根据金属活动性顺序表,Cu不能发生:Cu+2H2O=Cu(OH)2↓+H2↑的反应。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四组电极和电解液中,能实现该反应最为恰当的是
| A | B | C | D |
阳极 | 石墨棒 | Cu | Cu | Cu |
阴极 | 石墨棒 | 石墨棒 | Fe | Pt |
电解液 | CuSO4溶液 | Na2SO4溶液 | H2SO4溶液 | H2O |
查看答案和解析>>
科目:高中化学 来源:2016届福建省福州八市高一下学期期中考试化学试卷(解析版) 题型:填空题
有V、W、X、Y、Z五种元素,它们的核电荷数依次增大;且都小于20。其中只有X、Z是金属元素;V、Z元素原子最外层都只有一个电子;W、Y元素原子的最外层电子数相同,且 W元素原子L层电子数是K层电子数的3倍;X元素原子的最外层电子数是Y元素原子最外层电子数的一半.由此推知:
V是 、W是 、X是 、Y是 、Z是 (填元素符号)
查看答案和解析>>
科目:高中化学 来源:2016届湖北省孝感市七校联考高一下学期期中考试化学试卷(解析版) 题型:选择题
下列不能说明氯元素的非金属性比硫元素强的事实是( )
①HCl比H2S稳定 ②HClO氧化性比H2SO4强 ③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S ⑤Cl原子最外层有7个电子,S原子最外层有6个电子 ⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS。
A.②⑤ B.①② C.①②④ D.①③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com