
I��NaOH��FeCl3����ѧ��ѧʵ���ҳ��õ��Լ���
��1����һ������������NaOH��Һ��Ӧ�Ĺ��嵥����________��________������������
����һ�����ʵ���Ũ�ȵ�NaOH��Һʱ�����ʵ����ƫ�͵�ԭ����________��
| A������ƿ��ԭ����������ˮ |
| B��ϴ���ձ��Ͳ���������Һδת������ƿ�У� |
| C������ʱ�۲�Һ�温�� |
| D���ܽ��δ����ȴ����ת��������ƿ�� |
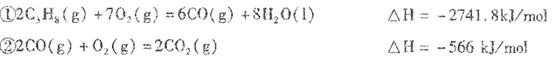
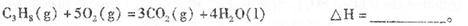
��1�������裨�� B
��2��2 Fe3+ +Cu="=2" Fe2+ + Cu2+
3ClO-+2 Fe3++10OH-="2" FeO42-+3Cl-+5H2O
��1��-2219.2KJ/mol
��2���� C3H8+10O2-��20e-=3CO2+4H2O
��3���д�����ɫ���ݲ����������а�ɫ����������
�������������(l)��NaOH��Һ��Ӧ�Ĺ��嵥���н��������ͷǽ������ʹ���
����һ�����ʵ���Ũ�ȵ�NaOH��Һʱ��A.����ƿ��ԭ����������ˮ,��Ӱ��������ҺŨ�ȡ�B.ϴ���ձ��Ͳ���������Һδת������ƿ�У����ʼ��٣�Ũ�ȼ�С��C. D�������������ܼ����������������ܼ���������ҺŨ��ƫ��
��2�� FeCl3���Ը�ʴ��·ͭ�壬����Fe3����ͭ���ʡ�
FeCl3 ��KClO��ǿ�����������Ʊ�K2FeO4������KClO��ǿ�����ԡ�
��1�����ø�˹���ɣ�����+�ڡ�3��/2, C3H8(g)+5O2(g)=3CO2(g)+4H2O (l) ��H=-2219.2KJ/mol
��2��ԭ��ص������Һ����������������صĸ�������������Ӧ��
��3�� �ö��Ե缫�������Mg(NO3)2��NaCl�Ļ����Һ������������ԭ��Ӧ��2H++2e-=H2��,������Χ��Һ��2OH-+Mg2+=" Mg" (OH)2��.


 �ŵ������ϵ�д�
�ŵ������ϵ�д� 53������ϵ�д�
53������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ӵ�ʳ���м���ĵ������һ�ְ�ɫ�ᾧ��ĩ�����ܽ�����¶�Ӱ��ܴ������¶ȵ����߶����������º��ȶ��������������µ������һ�ֽ�ǿ��������������⻯��Ȼ�ԭ�����ʷ�����Ӧ��
��1��Ϊ����ijʳ�����Ƿ���KIO3��ijͬѧȡʳ����Ʒ��ȫ�ܽ���ˮ�У�Ȼ������������ữ�ĵ���KI��Һ�������Һ����ɫ����Ӧ�����ӷ���ʽΪ ��
��2��KIO3Ҳ���õ��ķ����Ƶã���ԭ������ʯīΪ�������Բ����Ϊ��������һ���¶Ⱥ͵����µ��KI��Һ���ܷ�Ӧ����ʽΪKI+3H2O=KIO3+3H2�����������ĵ缫��Ӧʽ�ֱ�Ϊ������ ������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��4���ƵĻ�����W��X��Y��Z������֮��������¹�ϵ��
��W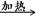 X��H2O��CO2��
X��H2O��CO2��
��Z��CO2�D��X��O2
��Z��H2O�D��Y��O2��
��X��Ca(OH)2�D��Y��CaCO3��
�Իش��������⣺
(1)W��X��Y��Z�Ļ�ѧʽ�ֱ��ǣ�W��________��X��________��Y��________��Z��________��
(2)����4����ѧ��Ӧ������������ԭ��Ӧ����________(�Ӧ���)����Ӧ����������________(д��ѧʽ)����ԭ����________(д��ѧʽ)��
(3)���ܷ�Ӧ����Һ�н��У�д�������ӷ���ʽ�Լ����ø����ӷ���ʽ��ʾ����һ����ѧ��Ӧ�Ļ�ѧ����ʽ�������ӷ���ʽ��__________________________���ڻ�ѧ����ʽ��_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����������ж���������Σ���ܴ���˺�����ˮ������д��������ŷš�
��֪��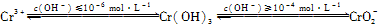
��1���ں���6�۸��ķ�ˮ�м���һ���������������������ʹ��6�۸���ԭ�ɣ�3�۸����ٵ�����ҺpH��6��8֮�䣬ʹFe3����Cr3��ת��ΪFe(OH)3��Cr(OH)3��������ȥ��
��д��Cr2O72-��FeSO4��Һ�����������·�Ӧ�����ӷ���ʽ��________________��
�������ӷ���ʽ��ʾ��ҺpH���ܳ���10��ԭ��____��
��2��������6�۸��ķ�ˮ��������ڣ������������������������Ȼ��ƽ��е�⡣���������ɵ�Fe2����Cr2O72-������Ӧ�����ɵ�Fe3����Cr3������������OH����ϳ����������������ȥ��
��д�������ĵ缫��Ӧʽ��________________��
�ڵ�ⷨ�м����Ȼ��Ƶ�������________________��
��3������ѧ�ḻ��ʣ����ڸ�����Ⱥã����������������������棬ͬ��������ɸ������ܵIJ���֣�CrO3���������ڵ�ƹ�ҵ�С�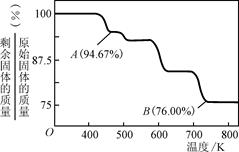
��CrO3����ǿ�����ԣ������л���(��ƾ�)ʱ�����ҷ�Ӧ�����Ż����ù������Ҵ������������ᣬCrO3����ԭ����ɫ�������[Cr2(SO4)3]����÷�Ӧ�Ļ�ѧ����ʽΪ____��
��CrO3�����ȶ��Խϲ����ʱ�ֽ⣬�������������¶ȵı仯����ͼ��ʾ����B��ʱʣ�����ijɷ���________________(�ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ͭ��CuFeS2������ͭ���仯�������Ҫԭ��֮һ���������Ʊ������Ļ����
��1��ұ��ͭ�ķ�ӦΪ8CuFeS2��21O2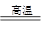 8Cu��4FeO��2Fe2O3��16SO2
8Cu��4FeO��2Fe2O3��16SO2
��CuFeS2��Fe�Ļ��ϼ�Ϊ+2����Ӧ�б���ԭ��Ԫ���� ����Ԫ�ط��ţ���
��2������ұ�������в�������SO2�����д��������������� ������ţ���
a���߿��ŷ� b�������Ʊ�����
c���ô�����Һ������Na2SO3 d����Ũ��������
��3����������أ�K2S2O8������ǿ�����ԣ��ɽ�I������ΪI2��S2O82����2I��=2SO42����I2
ͨ���ı䷴Ӧ;����Fe3���ɴ�������Ӧ���������ӷ���ʽ��ʾFe3����������Ӧ�Ĵ����̡� ��
��
��������ƽ��ÿ��1�֣���
��4�����û�ͭ��ұ��ͭ������¯����Fe2O3��FeO��SiO2��Al2O3�����Ʊ�Fe2O3������Ϊ
����ϡ�����ȡ¯�������ˡ�
����Һ���������ټ������NaOH��Һ�����ˣ�������ϴ�ӡ�������յá�
��������Ϣ�ش��������⣺ѡ���ṩ���Լ������ʵ����֤¯���к���FeO��
�ṩ���Լ���ϡ���� ϡ���� KSCN��Һ KMnO4��Һ NaOH��Һ ��ˮ
��ѡ�Լ�Ϊ ��֤��¯���к��е�ʵ������Ϊ
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ijǿ������ҺX���ܺ���Ba2+��A13+��NH4+��Fe2+��Fe3+��CO32-��SO32-��SO42-��C1-��NO3-�е�һ�ֻ��֣�ȡ����Һ��������ʵ�飬ʵ��������£�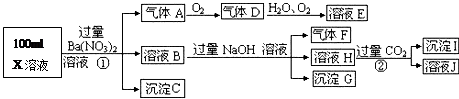
����������Ϣ���ش��������⣺
��1������FΪ
��2�����������У���ҺX�г�H+��϶����е������� ������ȷ���Ƿ��е������� ��
��3��д������A�����ӷ���ʽ��
��4��ͨ����������KClO�ڼ�������������G���Ʊ�һ�����͡���Ч�����ˮ������K2FeO4����д���Ʊ������е����ӷ���ʽ ��
��5������ⶨA��F��I��Ϊ0.1mol��100mL X��Һ��n��H+��=0.4mol���Ҳ���ȷ��������ֻ��һ�֡���X��Һ�в���ȷ���������� �������C�����ʵ���Ϊ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij���������Թ�ҵ��ˮ�к���һ������Fe3+��Cu2+��Au3+�����ӡ����������ͼ�еĹ������̣����ó��õ��ᡢ���ҵ�����еķ���м���ӷ�ˮ�л��ս𣬲�����һ���������죨Fe2O3��������ͭ������֪ͭ���ܽ���ϡ��������������ͭ��Һ��
����д����հף�
��1��ͼ�б�Ŵ���������Ӧ���ʷֱ��ǣ��ѧʽ���� ��
�� �� ��
��2��A������ɷ�Ϊ ���ѧʽ��
��3��д���ݴ���Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij�ӵ������мס��������������������ŷŵij��幤ҵ��ˮ�У�������Na+��Ag+��Fe3+��C1-��OH-��NO3-�������ӡ�
��1�����ⶨ�׳��ķ�ˮ���Գ����ԣ����ҳ���ˮ����������������Ӧ���� ��
��2�����Ҫ���շ�ˮ�еĽ������������ڷ�ˮ�м��������һ�ֳ�����������Ӧ�����Һ��ֻ��һ�ֽ��������ӣ��������ù���ijɷ��� ��Ҫ��һ����������������� ��
��3�����׳����ҳ��ķ�ˮ���ʵ��ı�����ϣ�����ʹ��ˮ�е�ijЩ����ת��Ϊ������д�����ɺ��ɫ���������ӷ���ʽ�ǣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1�������������ж���������Σ���ܴ���˺�����ˮ������д��������ŷš�
��֪��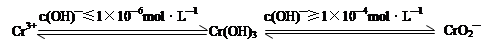
�ں�+6�۸��ķ�ˮ�м���һ���������������������ʹ+6�۸���ԭ��+3�۸����ٵ�����ҺpH��6��8֮�䣬ʹFe3+��Cr3+ת��ΪFe(OH)3��Cr(OH)3��������ȥ��
��д��Cr2O72����FeSO4��Һ�����������·�Ӧ�����ӷ���ʽ ��
����������ӷ���ʽ��ʾ��ҺpH���ܳ���10����c(OH)����1��10��4mol��L��1����ԭ��ΪCr(OH)3 �� OH���� ��2H2O��
��2�������Ṥҵ�����������У��������������ų���β���������������0.5% NO��1.5% NO2���ô�����Һ��ȫ���գ���ɷ�Ӧ����ʽ��NO��3NO2��2Na2CO3��3NaNO2��NaNO3��2 ���÷�Ӧ�����ô����������������Һ������Ӧ��ԭ����������Na2CO3ˮ����ֵ� �ԡ�
��3��һ��Ũ�ȵ�HF��Al2(SO4)3���Һ�У����ĸ���������?��pH�ķֲ�������ͼʾ����NaOHʹ���Һ��pH��5������7������йط�Ӧ�����ӷ���ʽΪ��
___________+3OH��=Al(OH)3��+2F����__________+3OH��=Al(OH)3��+3F����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com