
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)如图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图:
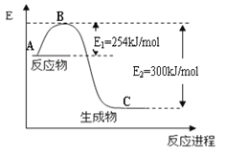
请写出NO2和CO反应的热化学方程式:___。
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g)+Q(Q>0),其化学平衡常数K与T的关系如下表:
2NH3(g)+Q(Q>0),其化学平衡常数K与T的关系如下表:
T/K | 298 | 398 | 498 | … |
K/ | 4.1×106 | K1 | K2 | … |
请完成下列问题:比较K1、K2的大小:K1___K2(填写“>”、“=”或“<”)
(3)判断该反应达到化学平衡状态的依据的是___(选填字母序号)。
A.2v(H2)正=3v(NH3)逆 B.2v(N2)正=v(H2)逆
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。盐酸肼第一步水解反应的离子方程式___;
盐酸肼水溶液中离子浓度的排列顺序正确的是___(填序号)。
a.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
b.c(Cl-)>c([N2H5H2O]+)>c(H+)>c(OH-)
c.2c(N2H62+)+c([N2H5H2O]+)+c(H+)=c(Cl-)+c(OH-)
d.2c(N2H62+)+2c([N2H5H2O]+)+2c([N2H42H2O]=c(Cl-)
【答案】NO2(g)+CO(g)=NO(g)+CO2(g)△H=-46 kJmol-1 > AC N2H62++H2O![]() [N2H5H2O]++H+ acd
[N2H5H2O]++H+ acd
【解析】
(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量300-254=46kJ,根据热化学方程式书写原则进行书写;
(2)①根据焓变判断生成物反应物浓度的变化,然后根据平衡常数判断;
②根据平衡状态的判断依据判断;
(3)①由N2H4,联想到NH3,由N2H6Cl2联想到NH4Cl,再注意到N2H4是二元碱而NH3是一元的,根据铵根离子的水解产物是氨水和氢离子来书写水解方程式;
②盐酸肼水溶液中水解原理与NH4Cl类似,N2H62+离子水解溶液显酸性。
(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量300-254=46kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-46 kJmol-1;
(2)①该反应正反应是放热反应,升高温度,平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,所以K1>K2;
②A.不同物质的正逆反应速率之比等于其计量数之比是平衡状态,则2v(H2)正=3v(NH3)逆能证明正逆反应速率相等,故A正确;
B.由2v(N2)正=v(H2)逆可知两者的正逆反应速率之比不等于其计量数之比,此时不是平衡状态,故B错误;
C.容器内压强不变,气体的物质的量不变,该反应达平衡状态,故C正确;
D.如果是在密闭容器中反应,质量不变,体积不变,密度始终不变,故D错误;
故答案为AC;
(3)①盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似,由N2H4联想到NH3,由N2H6Cl2联想到NH4Cl,再注意到N2H6是二元碱而NH3是一元的,则盐酸肼第一步水解反应的离子方程式为N2H62++H2O[N2H5H2O]++H+;
②盐酸肼水溶液中水解原理与NH4Cl类似,N2H62+离子水解溶液显酸性;
a.溶液中离子浓度大小为:c(Cl-)>c(N2H62+)>c(H+)>c(OH-),故a正确;
b.盐酸肼第一步水解反应的离子方程式为N2H62++H2O[N2H5H2O]++H+,考虑水的微弱电离,所以c(H+)>c([N2H5H2O]+),故b错误;
c.电荷守恒可知:2c(N2H62+)+c([N2H5H2O]+)+c(H+)═c(Cl-)+c(OH-),故c正确;
d.盐酸肼水溶液中存在的物料守恒式为2c(N2H62+)+2c([N2H5H2O]+)+2c([N2H42H2O]=c(Cl-),故d正确;
故答案为:acd。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)=2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1。对此反应速率的表示,正确的是( )
A.用A表示的反应速率是0.4 mol·(L·min)-1
B.分别用B、C、D表示反应的速率,其比是3∶2∶1
C.在2 min末的反应速率,用B表示是0.3 mol·(L·min)-1
D.在这2 min内用B和C表示的平均反应速率的值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液均为0.1mol·L-1,有关叙述正确的是( )
A.碳酸氢钠溶液中c(H2CO3)>c(CO32-)
B.碳酸钠溶液比碳酸氢钠溶液的pH小
C.碳酸钠溶液中c(OH-)=c(H+)+c(H2CO3)+c(CO32-)
D.碳酸钠溶液中滴加盐酸至pH=7,所得溶液的溶质只有NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要用480mL0.1molL-1的硫酸铜溶液,以下配制方法正确的是( )
A. 称取![]() 胆矾(CuSO4·5H2O),配成500mL溶液
胆矾(CuSO4·5H2O),配成500mL溶液
B. 称取![]() 胆矾(CuSO4·5H2O),加入500mL水配成溶液
胆矾(CuSO4·5H2O),加入500mL水配成溶液
C. 称取![]() 无水硫酸铜粉末,加入480mL水配成溶液
无水硫酸铜粉末,加入480mL水配成溶液
D. 称取![]() 无水硫酸铜粉末,加入500mL水配成溶液
无水硫酸铜粉末,加入500mL水配成溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知该反应4NH3+5O2=4NO+6H2O中,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是
A.![]() v(NH3)=v(O2)B.
v(NH3)=v(O2)B.![]() v(O2)=v(H2O)
v(O2)=v(H2O)
C.![]() v(NH3)=v(H2O)D.
v(NH3)=v(H2O)D.![]() v(O2)=v(NO)
v(O2)=v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水硫酸铜在加热条件下能发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气。某学生试图用如图所示装置来确定该化学反应中各物质的计量关系。
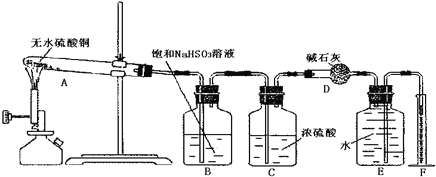
试回答:
(1)加热过程中,试管A中发生的实验现象可能有___。
(2)装置E和F的作用是___;
(3)该学生使用装置B的本意是除去混合气体中的三氧化硫以提纯氧气,他的做法正确吗?为什么?___。
(4)另一学生将9.6g无水硫酸铜充分加热使其完全分解后,用正确的实验方法除去了生成物中的二氧化硫和三氧化硫,最后测出氧气的体积为448mL(标准状况)。据此可计算出二氧化硫为___mol,三氧化硫为___mol。
(5)由上述实验数据可知无水硫酸铜受热分解的化学方程式:___。
(6)上述装置可以简化而不影响实验效果。请你提出一个简化方案,达到使装置最简单而不影响实验效果的目的:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1乙氧基萘常用作香料,也可合成其他香料。实验室制备1乙氧基萘的过程如下:
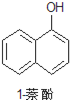 +CH3CH2OH
+CH3CH2OH![]()
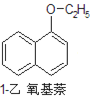 +H2O
+H2O
已知:1萘酚的性质与苯酚相似,有难闻的苯酚气味。相关物质的物理常数:
物质 | 相对分子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度 | |
水 | 乙醇 | |||||
1萘酚 | 144 | 无色或黄色菱形结晶或粉末 | 96℃ | 278℃ | 微溶于水 | 易溶于乙醇 |
1乙氧基萘 | 172 | 无色液体 | 5.5℃ | 267℃ | 不溶于水 | 易溶于乙醇 |
乙醇 | 46 | 无色液体 | 114.1℃ | 78.5℃ | 任意比混溶 | |
(1)将一定量1萘酚溶于无水乙醇中,并加入少量浓硫酸混合。将混合液置于如图所示的容器中加热充分反应。实验中使用过量乙醇的原因是__________。
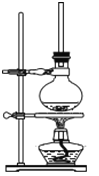
(2)装置中长玻璃管的作用是:______。
(3)该反应不能用实验室制备乙酸乙酯的装置,简述理由____________;
(4)反应结束,需要提纯产物,在下面的横线上填上相应操作的名称:倒入冷水,碱洗并_______ → 水洗并_______ →加入CaCl2干燥并______→___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,从海水提取的溴占世界溴年产量的三分之一左右,空气吹出法是工业规模海水提溴的常用方法。其中一种工艺流程为:①海水浓缩,酸化;②通入Cl2,使Br— 转化为Br2;③通入空气、水蒸气,将Br2吹入吸收塔,与吸收剂SO2反应转化为HBr;④通入Cl2,再经过一系列处理得到产品Br2。请回答下列问题:
(1)步骤②、③操作的目的是_____(填“富集溴”或“萃取溴”);
(2)在步骤③中,生成HBr的化学方程式是___________;
(3)在步骤②中,若通入22.4LCl2(标准状况),理论上可得Br2__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法错误的是
A.2.5 g NaD与足量水反应生成的氢气中含中子数0. 1NA
B.0.1 mol H2O与0. 1 mol H2O2含H—O键数目均为0. 2NA
C.0.1 mol Na2CO3NaHCO32H2O溶于水形成的1 L溶液中CO32一和HCO3一数目之和为0.2NA
D.电解精炼铜时,阴极增重64 g时,转移的电子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com