
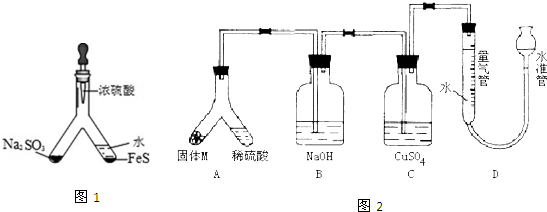
| V |
| 22400 |
| V |
| 22400 |
| V |
| 400 |
| V |
| 400 |


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
| A、78 | B、140 |
| C、156 | D、172 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法错误的是( )
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法错误的是( )| A、用KI淀粉试纸和食醋无法检验加碘盐中是否含有碘 |
| B、足量Cl2能使湿润的KI淀粉试纸变白的原因可能是:5Cl2+I2+6H2O→2HIO3+10HCl |
| C、由图可知氧化性的强弱顺序为Cl2>IO3->I2 |
| D、途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2SO3溶液(BaCl2溶液) |
| B、FeCl2溶液(KSCN溶液) |
| C、KI溶液(淀粉溶液) |
| D、氯水(品红溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:
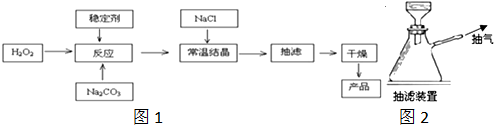
查看答案和解析>>
科目:高中化学 来源: 题型:
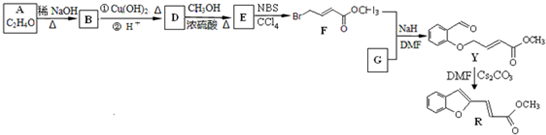
| 稀NaOH |
| △ |
 +H2O(R、R1表示烃基或氢)
+H2O(R、R1表示烃基或氢)| Cl2/光照 |
| NaOH、H2O |
| ①O2、催化剂△ |
| ②H+ |
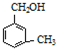 互为同系物
互为同系物查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用容量瓶配制溶液时,定容时仰视刻度线,所配溶液浓度偏小 |
| B、用润湿的pH试纸测溶液的pH,所测pH不一定有误差 |
| C、测定中和反应的反应热时,将碱分多次倒入酸中,所测△H偏小 |
| D、酸碱中和滴定时,滴定前盛装标准液的滴定管内有气泡,终点读数时气泡消失,所测结果偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com