
| 1mol×16 |
| 2 |
| 1mol×5 |
| 2 |


科目:高中化学 来源: 题型:
| A、“摩尔”是某基本物理量的基本单位 |
| B、1mol水中含有2mol氢和1mol氧 |
| C、NaOH 的摩尔质量是40 g |
| D、0.012kg C-14中含有阿伏伽德罗常数个碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
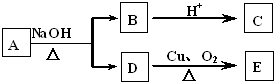
| A、1种 | B、2种 | C、3种 | D、4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
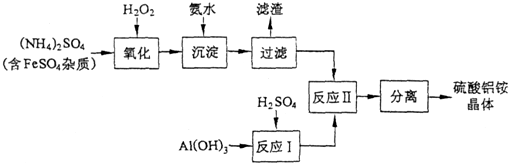
查看答案和解析>>
科目:高中化学 来源: 题型:
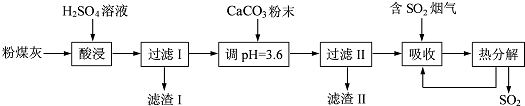
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向溴乙烷中加入NaOH溶液,加热,充分反应后,加入AgNO3溶液 | 观察生成沉淀的颜色,以确定含有溴元素 |
| B | 向乙醛溶液中加入新制的银氨溶液,用酒精灯直接加热 | 确定乙醛中是否含有醛基 |
| C | 向苯和酒精的混合液中加入金属钠 | 确定苯中是否有酒精 |
| D | 纯净的乙炔气通入溴水溶液中,溴水褪色,且溶液pH前后变化不大 | 说明乙炔与Br2发生了加成反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com