
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 无色透明溶液中: Ca2+、Cu2+、Br-、Cl-
B. 能使酚酞变红的溶液中: K+、Na+、CO![]() 、AlO
、AlO![]()
C. c(ClO-)=1mol·L-1的溶液中: Fe2+、Al3+、NO![]() 、I-
、I-
D. ![]() =0.1 mol·L-1的溶液中: NH
=0.1 mol·L-1的溶液中: NH![]() 、Mg2+、SO
、Mg2+、SO![]() 、CH3COO-
、CH3COO-
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,3.4 g D2O2所含极性键数目为0.2NA
B. 25℃,pH =2的H2SO4溶液中,H+的数目为0.02 NA
C. 标准状况下,2.24 L CCl4含有的分子数目为0.1NA
D. lmol OH-含有的电子数目为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
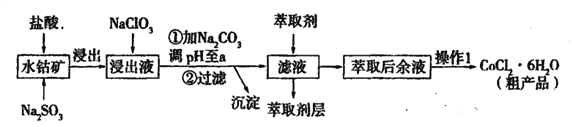
已知:①浸出液含有的阳离子主要有,H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe( OH)3 | Fe(OH)2 | Co(OH)2 | Al( OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)①浸出过程中加入Na2SO3的目的是____。
②向浸出液中加入NaClO3的离子反应方程式为____。
③为提高浸取率除了适当增大NaClO3浓度,升高温度还可采取措施____(答一条即可)。若不慎向“浸出液”中加入NaClO3过量时,可能会生成有毒气体,写出生成该有毒气体的离子方程式____。
(2)①“加Na2CO3调pH至a”,过滤所得到的沉淀成分为____。
②萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是____;其使用的适宜pH范围是____(填编号)。
A.2.0—2.5 B. 3.0—3.5 C.4.0—4.5 D.5.0—5.5

③“操作1”中包含的基本实验操作,它们依次是_______、____和过滤、减压烘干。
(3)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤,洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是____(答一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘与氢气反应的有关热化学方程式如下,下列说法正确的是
① I2(g)+H2(g) ![]() 2HI(g) △H=-9.48 kJ·mol–1
2HI(g) △H=-9.48 kJ·mol–1
② I2(s)+H2(g) ![]() 2HI(g) △H=+26.48 kJ·mol–1
2HI(g) △H=+26.48 kJ·mol–1
A.①的产物比②的产物稳定
B.②的反应物总能量比①的反应物总能量低
C.I2(s) ![]() I2(g) △H=+17.00 kJ·mol–1
I2(g) △H=+17.00 kJ·mol–1
D.在装有1mol I2(g)的密闭容器中通入1 mol H2(g),发生反应时放热9.48 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有下列6种离子中的某几种:Cl、SO42—、NH4+、CO32—、K+、Na+。为确认溶液组成进行如下实验:
①200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。
②向①的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12 L(已换算成标准状况,假定产生的气体全部逸出)。
(1)溶液一定存在的离子有____,可能存在的离子有______;
(2)原溶液中c(CO32—)为____,c(NH4+)____c(SO42—) (填“>、<或=”);
(3)如果上述6种离子都存在,则c(Cl)__c(SO42—) (填“>、<或=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置的说法正确的是( )
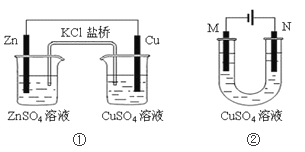
A. 装置①中盐桥内的K+移向ZnSO4溶液
B. 若装置②用于铁棒镀铜,则M极为铁棒
C. 若装置②中N极为铁棒,M极为石墨,则铁棒不易被腐蚀
D. 若装置②用于电解精炼铜,则溶液中Cu2+浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。向恒容密闭容器中充入0.1 mol CH4和0.2 mol H2S,不断升高温度,测得平衡时体系中各物质的物质的量分数与温度的关系如下图所示:
CS2(g)+4H2(g)。向恒容密闭容器中充入0.1 mol CH4和0.2 mol H2S,不断升高温度,测得平衡时体系中各物质的物质的量分数与温度的关系如下图所示:
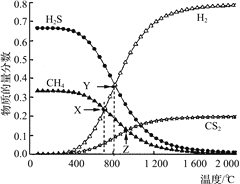
下列说法正确的是( )
A. 该反应的ΔH<0
B. X点CH4的转化率为20%
C. X点与Y点容器内压强比为51∶55
D. 维持Z点温度,向容器中再充入CH4、H2S、CS2、H2各0.1 mol时v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫氰酸盐、苯酚及硫代硫酸盐是HPF脱硫废液中的主要污染物(其中还含有Cl-、SO![]() 、Na+等),可用NaClO3、H2SO4作脱除的试剂。
、Na+等),可用NaClO3、H2SO4作脱除的试剂。
(1)Cl2与热的NaOH溶液反应生成NaClO3,该反应的化学方程式为____________________________。
(2) 常温时,反应C6H5O-+H2O ![]() C6H5OH+OH-的平衡常数为K=________(C6H5OH的Ka=1×10-10)。
C6H5OH+OH-的平衡常数为K=________(C6H5OH的Ka=1×10-10)。
(3)处理该废水需经预处理和再处理阶段。
①用浓硫酸对600 mL HPF脱硫废液进行酸化预处理(反应温度100℃),其结果如表1所示:
表1 预处理前后三种离子浓度变化情况
项目 | S2O | SCN-(g·L-1) | 苯酚(g·L-1) | pH |
处理前 | 34.28 | 70.11 | 1.3 | 8.55 |
处理后 | 0.91 | 69.76 | 1.35 | 2.4 |
由表1可知,该处理过程中主要被除去的污染物是________。
②对预处理后废液进行再处理(反应温度100 ℃)时,13次依次向废液中加入试剂情况如表2所示:
表2 13次依次加入试剂情况
次数 | 1 | 2 | 3 | 4 | span>5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
NaClO3/g | 16.3 | 0 | 0 | 0 | 0 | 0 | 7.6 | 0 | 5.7 | 0 | 10.9 | 0 | 7.1 |
浓H2SO4/mL | 0 | 2 | 2 | 2 | 4 | 4 | 0 | 4 | 0 | 4 | 0 | 4 | 0 |
实验结果如图1所示:
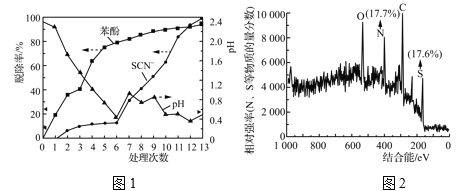
前![]() 和Cl-反应产生Cl2有关。该白色沉淀可能的结构简式为______________。
和Cl-反应产生Cl2有关。该白色沉淀可能的结构简式为______________。
③由表2和图1中数据得出,第7~13次操作中SCN-在较强酸性条件下被ClO![]() (不水解)氧化的依据是________。此过程中产生大量砖红色沉淀(夹杂少量白色沉淀),对沉淀进行XPS分析,部分元素的物质的量分数如图2所示。已知SCN-可被某些氧化剂(如Cu2+等)最终氧化为砖红色的沉淀(SCN)x。一种推测认为该实验中产生的砖红色沉淀为(SCN)x,支持该推测的证据有:________。
(不水解)氧化的依据是________。此过程中产生大量砖红色沉淀(夹杂少量白色沉淀),对沉淀进行XPS分析,部分元素的物质的量分数如图2所示。已知SCN-可被某些氧化剂(如Cu2+等)最终氧化为砖红色的沉淀(SCN)x。一种推测认为该实验中产生的砖红色沉淀为(SCN)x,支持该推测的证据有:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/LNaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A. V(NaOH)=0时,c(H+)=1×10-2mol/L
B. V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-)
C. V(NaOH)=10mL时,c(H+)=1×10-7mol/L
D. V(NaOH)>10mL时,c(Na+)>c(C2O42-)>c(HC2O4-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com