
【题目】乙二酸俗称草酸(结构简式为HOOC—COOH,可简写为H2C2O4),它是一种重要的化工原料。(常温下0.01 mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示。)填空:
H2C2O4 | KHC2O4 | K2C2O4 | |
pH | 2.1 | 3.1 | 8.1 |
(1)写出H2C2O4的电离方程式________________。
(2)KHC2O4溶液显酸性的原因是_________________;向0.1 mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______。
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-) b.c(Na+)=c(H2C2O4)+c(C2O42-)
c.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-) d.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失。写出反应的离子方程式____________________;又知该反应开始时速率较慢,随后大大加快,可能的原因是______________________。
【答案】H2C2O4![]() H++HC2O4-、HC2O4-
H++HC2O4-、HC2O4-![]() H++C2O42- HC2O4-的电离程度大于水解程度 ad 5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O 反应生成的Mn2+对该反应具有催化作用
H++C2O42- HC2O4-的电离程度大于水解程度 ad 5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O 反应生成的Mn2+对该反应具有催化作用
【解析】
(1)常温下0.01 mol/L的H2C2O4溶液的pH为2.1,KHC2O4的pH为3.1,说明草酸是二元弱酸;
(2)HC2O4-既能够电离也能够水解,KHC2O4溶液显酸性,说明HC2O4-的电离程度大于水解程度;
a.根据物料守恒判断;
b.根据电荷守恒判断;
c.根据物料守恒、电荷守恒判断;
d.若恰好反应,c(K+)=c(Na+),此时溶液呈碱性,故加入的氢氧化钠的物质的量略少些;
(3)草酸和高锰酸钾溶液反应在酸性溶液中发生氧化还原反应,草酸被氧化为二氧化碳,高锰酸钾被还原为锰离子;反应开始时速率较慢,随后大大加快,说明生成的Mn2+对该反应具有催化作用。
(1)二元弱酸分步电离,草酸电离方程式为:H2C2O4![]() H++HC2O4-、HC2O4-
H++HC2O4-、HC2O4-![]() H++C2O42-;
H++C2O42-;
(2)HC2O4-既能够电离也能够水解,KHC2O4溶液显酸性,说明HC2O4-的电离程度大于水解程度。
a. 碳元素在溶液中存在形式有:HC2O4-、H2C2O4、C2O42-,根据物料守恒有c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-),A正确;
b. 根据电荷守恒有:c(K+)+c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),溶液呈中性,则c(H+)=c(OH-),故c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-),B错误;
c. 由物料守恒可得c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)、根据电荷守恒可得:c(K+)+ c(Na+)=c(HC2O4-)+2c(C2O42-)可知,c(Na+)=c(C2O42-)-c(H2C2O4),C错误;
d. 若恰好反应,c(K+)=c(Na+),此时得到的盐是强碱弱酸盐,水溶液呈碱性,故若溶液显中性,则加入的氢氧化钠的物质的量略少些,所以c(K+)>c(Na+),D正确;
故合理选项是ad;
(3)草酸和高锰酸钾溶液反应在酸性溶液中发生氧化还原反应,草酸被氧化为CO2,高锰酸钾被还原为Mn2+,根据电子守恒、电荷守恒、原子守恒,可得反应的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,反应开始时速率较慢,随后大大加快,说明反应生成的Mn2+对该反应具有催化作用。


科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列有关物质的用途、性质都正确且有相关性的是
选项 | 用途 | 性质 |
A | 液氨作制冷剂 | NH3分解生成N2和H2的反应是吸热反应 |
B | NH4Fe(SO4)2·12H2O常作净水剂 | NH4Fe(SO4)2·12H2O具有氧化性 |
C | 漂粉精可以作环境消毒剂 | 漂粉精溶液中ClO-和HClO都有强氧化性 |
D | Al2O3常作耐高温材料 | Al2O3,既能与强酸反应,又能与强碱反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有同学研究从矿石开始到产出钢铁的工艺流程。
(1)将6.62g铁矿石样品投入足量的盐酸中完全溶解后过滤,滤渣中不含铁元素。在滤液中加过量的NaOH溶液,充分反应,过滤、洗涤、灼烧得4.80g Fe2O3。求该铁矿石含铁的质量分数。___________
(2)现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00吨生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)___________
(3)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况),计算此钢样粉末中铁和碳的物质的量之比。___________
(4)再取三份不同质量的上述钢样粉末,分别加到100mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入钢样粉末的质量/g | 2.812 | 5.624 | 8.436 |
生成气体的体积/L(标准状况) | 1.120 | 2.240 | 2.800 |
计算硫酸溶液的物质的量浓度___________
(5)若在实验Ⅱ中继续加入mg钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用酚酞作指示剂,用 0.10mol·L-1NaOH 溶液分别滴定 20.00mL 浓度均为0.10mol·L-1的CH3COOH 溶液和 HCN 溶液所得滴定曲线如图。(已知电离平衡常数:CH3COOH> HCN)
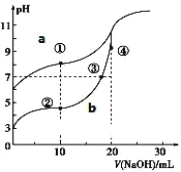
(1)图_____(a 或 b)是 NaOH 溶液滴定 HCN 溶液的 pH 变化的曲线。
(2)点③所示溶液中所含离子浓度的从大到小的顺序:_____ 。
(3)点①和点②所示溶液中:c(CH3COO-)-c(CN-)_____c(HCN)-c(CH3COOH)(填“>、<或=”)
(4)25 ℃时,用 0.1 mol·L-1的醋酸溶液滴定 20 mL 0.1 mol·L-1 的 NaOH 溶液,当滴加V mL 该醋酸溶液时, 混合溶液的 pH = 7 。已知醋酸的电离平衡常数为 Ka , 则Ka=________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石墨为电极分别电解水和饱和食盐水,关于两个电解池反应的说法正确的是( )
A.阳极反应式相同
B.电解结束后所得液体的pH相同
C.阴极反应式相同
D.通过相同电量时生成的气体总体积相等(同温同压)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )
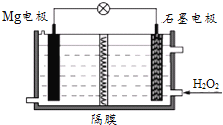
A.Mg电极是该电池的正极
B.溶液中的Cl-向正极移动
C.H2O2在石墨电极上发生氧化反应
D.石墨电极附近溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下反应:X(g)+Y(g)![]() Z(g)+W(s) ΔH>0,下列叙述不正确的是
Z(g)+W(s) ΔH>0,下列叙述不正确的是
A. 在容器中加入氩气,反应速率不变
B. 加入少量W,逆反应速率不变
C. 升高温度,正反应速率增大,逆反应速率减小
D. 将容器的体积压缩,可增大单位体积内活化分子数,有效碰撞次数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙3个烧杯中分别装有稀H2SO4、CuCl2溶液、饱和食盐水,甲中电极为锌片和铜片,乙中电极为石墨棒C1、C2,丙中电极为石墨棒C3、铁片,电极之间用导线相连。则下列叙述不正确的是
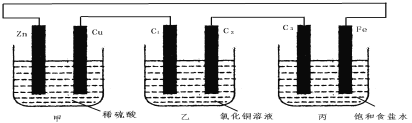
A.甲是化学能转变为电能,乙、丙是电能转变为化学能
B.C1、C2分别是阳极、阴极,锌片、C3上都发生氧化反应
C.C1和C3放出的气体相同,铜片和铁片放出的气体也相同
D.甲中溶液的pH逐渐升高,乙、丙中溶液的pH逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO |
B | 向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L MgCl2溶液,再加入3滴1 mol/L FeCl3溶液 | 先出现白色沉淀后又生成红褐色沉淀 | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 |
C | 在滴有酚酞的Na2CO3溶液中, 加入BaC12 | 溶液红色褪去 | CO32-在溶液中存在水解平衡 |
D | 常温下,测定盐酸和醋酸溶液的pH | 盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com