
【题目】已知下列热化学方程式:
①H2(g)+1/2O2(g)![]() H2O(l) ΔH=285.8 kJ·mol1
H2O(l) ΔH=285.8 kJ·mol1
②H2(g)+1/2O2(g)![]() H2O(g) ΔH=241.8 kJ·mol1
H2O(g) ΔH=241.8 kJ·mol1
③C(s)+ 1/2O2(g)![]() CO(g) ΔH=110.5 kJ·mol1
CO(g) ΔH=110.5 kJ·mol1
④C(s)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1
CO2(g) ΔH=393.5 kJ·mol1
回答下列各问题:
(1)上述反应中属于放热反应的是_______________________。
(2)H2的燃烧热为________
(3)燃烧10 g H2生成液态水,放出的热量为________。
(4)CO的燃烧热为________;其热化学方程式为______________。
【答案】①②③④ 285.8kJmol-1 1429.0 kJ 283.0 kJ/mol CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ/mol
O2(g)=CO2(g) △H=-283.0kJ/mol
【解析】
(1)放热反应的焓变小于0;
(2) 根据燃烧热的概念;
(3) 根据2gH2燃烧生成液态水放出285.8kJ的热量计算;
(4)观察题给方程式,不难看出,题目要求写出的方程式可据盖斯定律,④-③得:CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ/mol。
O2(g)=CO2(g) △H=-283.0kJ/mol。
(1)已知四个热化学方程式的焓变都小于0,故都是放热反应,
故答案为:①②③④;
(2)燃烧热为1 mol纯物质完全燃烧生成稳定氧化物时放出的热量,所以H2的燃烧热为285.8kJmol-1;
故答案为:285.8kJmol-1;
(3)2gH2燃烧生成液态水放出285.8kJ ,则燃烧10 g H2生成液态水Q放=![]() ×285.8 kJ=1 429.0 kJ。
×285.8 kJ=1 429.0 kJ。
故答案为:1429.0 kJ;
(4)据盖斯定律,④-③得:CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ/mol,故CO的燃烧热为283.0 kJ/mol,
O2(g)=CO2(g) △H=-283.0kJ/mol,故CO的燃烧热为283.0 kJ/mol,
故答案为:283.0 kJ/mol;CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ/mol。
O2(g)=CO2(g) △H=-283.0kJ/mol。


科目:高中化学 来源: 题型:
【题目】I.如图所示为常见玻璃仪器的部分结构:
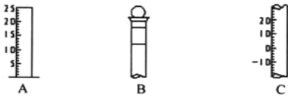
(1)请写出所列仪器的名称:A__________,B____________;C_____________;
(2)仪器 B 使用前必须______________________。
(3)仪器 B 上标记有__________________(填序号);
①质量 ②温度 ③刻度线 ④浓度 ⑤容积
II. 某无色工业废水中可能含有Na+、Mg2+、Al3+、Cl-、SO42-中的几种离子。
a.取少许该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,产生白色沉淀,充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生。
b.另取10mL该废水于试管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解。生成沉淀的物质的量随加入NaOH的物质的量关系如下图所示。
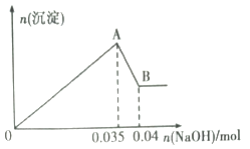
根据上述实验和图中数据:
(1)该废水中一定不含有的离子有________________(填离子符号);
(2)写出A→B过程中发生反应的离子方程式:_________________;
(3)该废水中,c(Al3+)=________________________;
(4)①实验室配制100mL2mol/L的NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要________(填仪器名称)。
②下列操作使所配溶液浓度偏大的是(填写字母)________。
A.称量用了生锈的砝码
B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶转移时,有少量液体贱出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 56 g Fe 与1mol Cl2充分反应,转移的电子数为3NA
B. 分子数为 0.1NA的CH4和NH3混合气体,含有的共用电子对数为0.4NA
C. 25℃时,1L pH=12的Ba(OH)2溶液中含有0.02NA 的OH-
D. 常温常压下,22 g D3O+中含有10NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一恒温、恒容的密闭容器中发生反应:3H2(g)+N2(g)![]() 2NH3(g) ΔH<0。t1时刻反应达到平衡,在t2时刻改变某一条件,其反应过程如图所示。下列说法正确的是
2NH3(g) ΔH<0。t1时刻反应达到平衡,在t2时刻改变某一条件,其反应过程如图所示。下列说法正确的是

A. Ⅰ、Ⅱ两过程达到平衡时,平衡常数:KⅠ<KⅡ
B. Ⅰ、Ⅱ两过程达到平衡时,NH3的体积分数:Ⅰ<Ⅱ
C. Ⅰ、Ⅱ两过程达到平衡的标志:气体的平均密度不再发生变化
D. t2时刻改变的条件可以是向密闭容器中加H2和N2的混合气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g) ![]() a Z(g)+W(g) ΔH=-Q kJ·mol-1(Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
a Z(g)+W(g) ΔH=-Q kJ·mol-1(Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值是____________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为____________。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?________,其理由是___________________。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是____________(稀有气体不参与反应)。
A.2 mol X、1 mol Y、1 mol Ar
B.a mol Z、1 mol W
C.1 mol X、0.5 mol Y、0.5a mol Z、0.5 mol W
D.2 mol X、1 mol Y、1 mol Z
(5)X的转化率α=____________(用含Q、Q1的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化在给定条件下每一步都能实现的是
A. Si![]() SiO2
SiO2![]() H2SiO3
H2SiO3
B. Mg(OH)2![]() MgCl2(aq)
MgCl2(aq) ![]() Mg
Mg
C. Al2O3![]() A1Cl3(aq)
A1Cl3(aq) ![]() 无水AlCl3
无水AlCl3
D. CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH3
CH3COOCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅石(主要成分SiO2)为起始原料生产高纯多晶硅的简化工艺流程如下图所示:
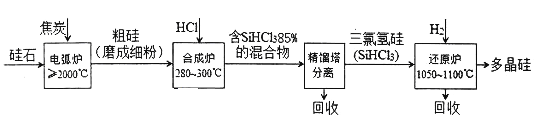
(1)在电弧炉中,生成粗硅的化学方程式为____________,该反应氧化剂与还原剂物质的量之比为_____________。
(2)合成炉中有关反应的数据如下表所示:
热化学方程式 | 平衡常数 | |
主反应 | Si(s)+3HCl(g) | K1 |
副反应 | Si(s)+4HCl(g) | K2 |
①主反应的温度需严格控制在280~300℃之间,若温度过低,则__________________;若温度太高,SiHCl3则会转化生成SiCl4,该转化的热化学方程式为_____________________。
②平衡时,![]() 的值a随着
的值a随着![]() 的值b的变化而变化,则
的值b的变化而变化,则![]() =______(用含K1、K2的代数式表示)。工业上用H2适当稀释HCl来提高
=______(用含K1、K2的代数式表示)。工业上用H2适当稀释HCl来提高![]() 的值,请用平衡移动原理加以解释________________________。
的值,请用平衡移动原理加以解释________________________。
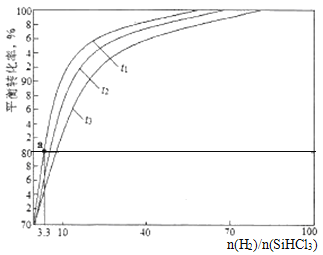
(3)还原炉中的主要反应为SiHCl3(g)+H2(g)=Si(s)+3HCl(g) △H>0。实验室中在1.0L密闭容器中研究得到SiHCl3的转化率在不同温度条件下随n(H2)/(SiHCl3)变化的曲线如图所示。t1、t2、t3表示的温度高低顺序为_______;t1温度时平衡常数Ka=______(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.05mol/LNaOH溶液分别滴定10.00mL浓度均为0.10 mol/LCH3COOH( Ka=l×10-5)溶液HCN(Ka=5×10-10)溶液,所得滴定曲线如图。下列说法正确的是

A. 对两种弱酸滴定均可选用甲基橙作指示剂
B. ③处溶液有:c(Na+)=c(CH3COO-)<c(CH3COOH)
C. 溶液中水的电离程度:②>③>④
D. 点①和点②溶液混合后:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com