
【题目】下列有关化学反应速率和限度的说法中,不正确的是
A. 实验室用H2O2分解制O2,加入MnO2后,反应速率明显加快
B. 在金属钠与足量水反应中,增加水的量能加快反应速率
C. 2SO2+O2![]() 2SO3反应中,SO2的转化率不能达到100%
2SO3反应中,SO2的转化率不能达到100%
D. 实验室用碳酸钙和盐酸反应制取CO2,用碳酸钙粉末比块状反应要快
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】物质X是某新型净水剂的中间体,它可以看成由氯化铝(在180 ℃升华)和一种盐A按物质的量之比1∶2组成。在密闭容器中加热8.75 g X使之完全分解,冷却后可得到3.2 g固体氧化物B、0.448 L无色气体D(体积已折算为标准状况)、4.27 g混合晶体E。B溶于稀盐酸后,滴加KSCN溶液,混合液变血红色。D气体能使品红溶液褪色。请回答下列问题:
(1)X的化学式为_________。
(2)将A固体隔绝空气充分灼烧,使其分解,生成等物质的量的B、D和另一种化合物,则A分解的化学方程式为_____________________________________________________。
(3)将E混合晶体溶于水配成溶液,逐滴加入过量稀NaOH溶液,该过程的总反应的离子方程式为________________________________。
E混合晶体中某种物质在一定条件下能和KI固体反应,写出该方程式:___________________。
(4)高温下,若在密闭容器中长时间煅烧X,产物中还有另外一种气体,其分子式是________。请设计实验方案验证之____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会密切相关。下列叙述不正确的是( )
A. 合成纤维和光导纤维都是新型无机非金属材料
B. 煤的气化和液化均属于化学变化
C. 医疗中常用酒精来消毒,是因为酒精能够使细菌蛋白质发生变性
D. NO2和SO2都是可形成酸雨的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】游离态的氮经一系列转化可以得到硝酸,如下图所示。

(1)NH3和O2在催化剂作用下反应,其化学方程式是______________。
(2)NO2→HNO3反应中氧化剂和还原剂的物质的量之比为________________。
(3)2NO(g)+O2(g) ![]() 2NO2(g)是制造硝酸的重要反应之一。在800℃时,向容积为1L的密闭容器中充入0.010molNO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
2NO2(g)是制造硝酸的重要反应之一。在800℃时,向容积为1L的密闭容器中充入0.010molNO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。

①2min内,v(O2)=________mol/(L·min)
②800℃时,该反应的化学平衡常数为__________。
③判断该反应达到平衡的依据是(写出2条即可)____________。
④已知:ⅰ.
ⅱ.N2(g)+2O2(g)=2NO2(g) ΔH=+68kJ·mol-1,写出NO生成NO2热化学方程式_____________,温度对于NO生成NO2平衡转化率的影响是:___________________。
(4)电解法处理含氮氧化物废气,可以回收硝酸。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极)。请写出电极过程中NO转化为硝酸的电极反应式:______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有HCO3-、SO32- 、CO32-、CH3COO-等4种阴离子。向其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)( )
A. CH3COO- B. SO32- C. CO32- D. HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氧化性Br2>Fe3+>I2,向含有Fe2+、Br-、I-各0.1 mol 的溶液中通入Cl2。通入Cl2的体积(标准状况)与溶液中某种离子(用Q表示)的物质的量的关系如下图所示,下列说法中正确的是( )

A. Q是I-
B. Q是Br-
C. b点时溶液中阴离子只有Cl-(不考虑OH-)
D. ab区间的反应:2Fe2++Cl2===2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、对N2(g)+3H2(g)![]() 2NH3(g) ΔH<0反应,其他条件不变情况下,改变起始氢气物质的量(用n(H2)表示),实验结果如下如图表示(图中T表示温度,n表示物质的量);
2NH3(g) ΔH<0反应,其他条件不变情况下,改变起始氢气物质的量(用n(H2)表示),实验结果如下如图表示(图中T表示温度,n表示物质的量);

(1)比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是______.
(2)若容器容积为1L,n=5mol,T2条件下反应达到平衡时H2的转化率为60%,则且H2与N2物质的量之比为1:1,则在起始时体系中加入N2的物质的量为______mol,反应的平衡常数K=______.
Ⅱ、煤制天然气的工艺流程如图所示:

(3)反应Ⅰ:C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH=+135kJ/mol,
CO(g)+H2(g) ΔH=+135kJ/mol,
①通入的氧气会与部分碳发生燃烧反应。请利用能量转化及配合移动原理说明通入氧气的作用:_______。
②若反应Ⅰ在体积不变的密闭容器中进行,下列能说明反应Ⅰ达到平衡状态的是________。
a.压强不变 b.气体密度不变 c.气体平均摩尔质量不变 d.氢气浓度不变
(4)反应Ⅱ:C0(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-41kJ/mol。如图3表示不同温度条件下,煤气化反应Ⅰ发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
CO2(g)+H2(g) ΔH=-41kJ/mol。如图3表示不同温度条件下,煤气化反应Ⅰ发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
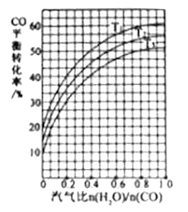
①判断T1、T2和T3的大小关系:________。(从小到大的顺序)
②若煤气化反应Ⅰ发生后的汽气比为0.8,经煤气化反应Ⅰ和水气变换反应Ⅱ后,得到CO与H2的物质的量之比为1:3,则反应Ⅱ应选择的温度是_________(填“T1”或“T2”或“T3”)。
(5)实验室模拟甲烷化反应:一定条件下,向体积为2L的恒容密闭容器中充入1.2molCH4(g)和4.8molCO2(g),发生反应CH4(g)+3CO2(g) ![]() 2H2O(g)+4CO(g) ΔH>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,20s内v(CH4)=______,此反应的ΔH =_____。
2H2O(g)+4CO(g) ΔH>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,20s内v(CH4)=______,此反应的ΔH =_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素的单质和化合物性质判断元素非金属性强弱的依据是
①元素最高价氧化物的水化物的碱性强弱 ②元素最高价氧化物的水化物的酸性强弱
③元素单质跟酸反应置换出氢的难易 ④元素单质跟氢气生成气态氢化物的难易
A.①②③④ B.③④ C.①②④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. 制作印刷电路板:Fe3++Cu===Cu2++Fe2+
B. 等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO![]() ===BaSO4↓+2H2O
===BaSO4↓+2H2O
C. Ca(OH)2溶液与足量Ca(HCO3)2溶液反应:Ca2++2HCO![]() +2OH-===2CaCO3↓+2H2O+CO
+2OH-===2CaCO3↓+2H2O+CO![]()
D. 新制饱和氯水中加入石灰石可提高溶液中HClO浓度:CaCO3+2Cl2+H2O===Ca2++2Cl-+CO2↑+2HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com