
| n |
| V |
| 1.6mol |
| 0.5L |
| 0.4mol |
| 0.5L |
| 0.8mol+0.6mol |
| 0.5L |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某物质的晶体中含Ti、O、Ca三种元素,其晶胞排列方式如图所示,晶体中Ti、O、Ca的中原子个数之比为( )
某物质的晶体中含Ti、O、Ca三种元素,其晶胞排列方式如图所示,晶体中Ti、O、Ca的中原子个数之比为( )| A、1:3:1 |
| B、2:3:1 |
| C、2:2:1 |
| D、1:3:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
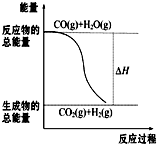 燃烧热是指一定条件下1mol可燃物完全燃烧生成稳定的氧化物时放出的热量.已知热化学方程式:①CO(g)+
燃烧热是指一定条件下1mol可燃物完全燃烧生成稳定的氧化物时放出的热量.已知热化学方程式:①CO(g)+| 1 |
| 2 |
| 1 |
| 2 |
| A、由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2 kJ?mol-1 | ||
| B、H2的燃烧热为241.8 kJ?mol-1 | ||
| C、H2(g)转变成H2O(g)的化学反应一定要释放能量 | ||
D、根据②推知反应H2(g)+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 被提纯物质 | 杂质 | 试剂 | 方法 |
| A | C2H6 | C2H4 | 溴水 | 洗气 |
| B | C2H4 | SO2 | KMnO4(H+) | 洗气 |
| C | 乙酸乙酯 | 乙酸 | 饱和Na2CO3溶液 | 分液 |
| D | 乙醇 | 水 | CaO | 蒸馏 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为比较Cl与S元素的非金属性强弱,相同条件下,测定相同浓度的NaCl溶液和Na2S溶液的pH值 |
| B、为观察Mg条在CO2气体中的燃烧,在一个集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶底部 |
| C、为比较HA和HB两种弱酸的Ka大小,可用pH计测定同温同浓度的NaA溶液和NaB 溶液的pH值 |
| D、为测定一定浓度的NaOH溶液放置空气中是否部分转化为Na2CO3,用甲基橙作指示剂,用标准盐酸溶液滴定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com