
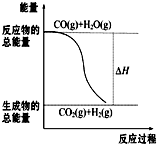
 燃烧热是指一定条件下1mol可燃物完全燃烧生成稳定的氧化物时放出的热量.已知热化学方程式:①CO(g)+
燃烧热是指一定条件下1mol可燃物完全燃烧生成稳定的氧化物时放出的热量.已知热化学方程式:①CO(g)+| 1 |
| 2 |
| 1 |
| 2 |
| A、由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2 kJ?mol-1 | ||
| B、H2的燃烧热为241.8 kJ?mol-1 | ||
| C、H2(g)转变成H2O(g)的化学反应一定要释放能量 | ||
D、根据②推知反应H2(g)+
|
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ① | ③ | ④ | ⑧ | ⑨ | |||
| 4 | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:
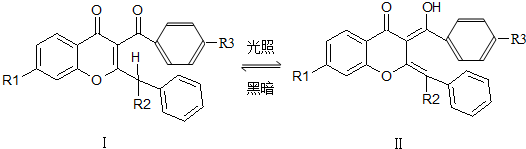
| A、Ⅰ和Ⅱ互为同分异构体 |
| B、Ⅰ、Ⅱ分子中所有原子都可能在同一平面上 |
| C、Ⅱ可看作醇类 |
| D、Ⅱ能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 起始温度t1℃ | 终止温度t2℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有反应:mA(g)+B(g)?2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
现有反应:mA(g)+B(g)?2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+、NO3-、Cl-、NH4+ |
| B、Ba2+、Mg2+、HCO3-、Cl-? |
| C、SO42-、Cl-、K+、NH4+ |
| D、SO32-、K+、AlO2-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl、CO和CO2 |
| B、HCl、H2和CO |
| C、CH4和NH3 |
| D、HCl和CO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com