
【题目】下列说法中不正确的是
A.漂白粉可以用于生活用水的消毒
B.石蕊溶液滴入氯水中,溶液变红,随后迅速褪色
C.氯气通入水中杀菌消毒,发生了化学变化
D.漂白粉在空气中久置变质,原因是原白粉中的CaCl2与空气中的CO2反应生成CaCO3
科目:高中化学 来源: 题型:
【题目】化学与生产、生活和社会密切相关。下列有关说法不正确的是![]()
A.发展“低碳经济”能够减少对化石能源的依赖
B.明矾溶于水会生成氢氧化铝胶体,故可用明矾作净水剂
C.铁制品在潮湿的空气中生锈,其主要原因是发生了析氢腐蚀
D.处理含![]() 的废水,常用FeS作沉淀剂,是因为CuS的溶解度比FeS小
的废水,常用FeS作沉淀剂,是因为CuS的溶解度比FeS小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿(主要成分Cu2S)作为铜矿中铜含量最高的矿物之一,可用来提炼铜和制备含铜化合物。
Ⅰ.湿法炼铜用Fe2(SO4)3溶液作为浸取剂提取Cu2+:
(1)反应过程中有黄色固体生成,写出反应的离子方程式______________________。
(2)控制温度为85℃、浸取剂的pH = 1,取相同质量的辉铜矿粉末分别进行如下实验:
实验 | 试剂及操作 | 3小时后Cu2+浸出率(%) |
一 | 加入10mL 0.25mol·L-1Fe2(SO4)3溶液和5 mL水 | 81.90 |
二 | 加入10 mL0.25mol·L-1Fe2(SO4)3溶液和5mL 0.1mol·L-1H2O2 | 92.50 |
回答:H2O2使Cu2+浸出率提高的原因可能是__________。
(3)实验二在85℃后,随温度升高,测得3小时后Cu2+浸出率随温度变化的曲线如图。Cu2+浸出率下降的原因_________________。
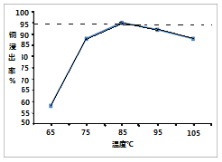
(4)上述湿法炼铜在将铜浸出的同时,也会将铁杂质带进溶液,向浸出液中通入过量的O2并加入适量的CuO,有利于铁杂质的除去,用离子方程式表示O2的作用_________。解释加入CuO的原因是_____。
Ⅱ.某课题组利用碳氨液((NH4)2CO3、NH3·H2O)从辉铜矿中直接浸取铜。
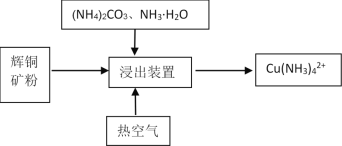
其反应机理如下:
①Cu2S(s)2Cu+(aq) +S2-(aq) (快反应)
②4Cu++O2+2H2O4Cu2++4OH- (慢反应)
③Cu2++4NH3·H2OCu(NH3)42++4H2O(快反应)
(5)提高铜的浸出率的关键因素是 ________。
(6)在浸出装置中再加入适量的(NH4)2S2O8,铜的浸出率有明显升高,结合平衡移动原理说明可能的原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1934年约里奥–居里夫妇在核反应中用α粒子(即氦核![]() )轰击金属原子
)轰击金属原子![]() ,得到核素
,得到核素![]() ,开创了人造放射性核素的先河:
,开创了人造放射性核素的先河:![]() +
+![]() →
→![]() +
+![]() 。其中元素X、Y的最外层电子数之和为8。下列叙述正确的是
。其中元素X、Y的最外层电子数之和为8。下列叙述正确的是
A.![]() 的相对原子质量为26
的相对原子质量为26
B.X、Y均可形成三氯化物
C.X的原子半径小于Y的
D.Y仅有一种含氧酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 0.1 mol·L-1的ZnCl2溶液中通入足量H2S,最终得不到ZnS沉淀是因为溶液中:c(Zn2+)·c(S2-)<Ksp(ZnS)
B. 根据Ksp(AgCl)=1.77×10-10,Ksp(Ag2CrO4)=1.12×10-12,可以推知AgCl的溶解度比Ag2CrO4的溶解度大
C. 向AgCl与AgNO3的浊液通入少量H2S,有黑色沉淀生成,则Ksp(AgCl)> Ksp(Ag2S)
D. 向碳酸钡沉淀中加入稀硫酸,沉淀发生转化,可推知硫酸钡的Ksp比碳酸钡的小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
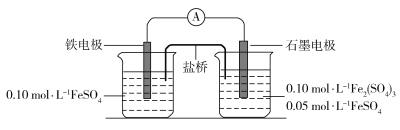
回答下列问题:
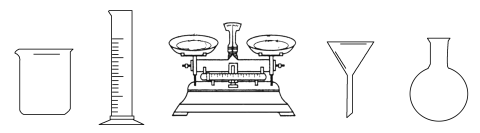
(1)由FeSO4·7H2O固体配制0.10 mol·L1 FeSO4溶液,需要的仪器有药匙、玻璃棒、_________(从下列图中选择,写出名称)。
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择____________作为电解质。
阳离子 | u∞×108/(m2·s1·V1) | 阴离子 | u∞×108/(m2·s1·V1) |
Li+ | 4.07 |
| 4.61 |
Na+ | 5.19 |
| 7.40 |
Ca2+ | 6.59 | Cl | 7.91 |
K+ | 7.62 |
| 8.27 |
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入________电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=________。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为_______,铁电极的电极反应式为_______。因此,验证了Fe2+氧化性小于________,还原性小于________。
(6)实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.常温常压下,28gCO与N2的混合气体所含有的原子数为2NA
B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14:1
C.同温同压下,相同质量的二氧化碳和二氧化硫的体积是16:11
D.常温常压下,0.5×6.02×1023一氧化碳分子所占体积是11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年北京奥运会主体育场“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884 块ETFE 膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法正确的是

A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga 处于IIIA 族,可推知氮化镓化学式为GaN
C.用金属铝与V2O5反应冶炼钒,V2O5作还原剂
D.ETFE 膜(![]() )是由一种单体加聚而成的
)是由一种单体加聚而成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C8H14O4的有机物在酸性条件下水解生成一种酸和一种醇,且酸和醇的物质的量之比为1:2,则符合该条件的有机物有( )(不考虑立体异构)
A.8种B.10种C.13种D.16种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com