
ЁОЬтФПЁПМзДМФЭИпЮТЁЂвзДцДЂШШжЕИпЁЂНкФмЛЗБЃЃЌПЩзіШМСЯЃЌгжЪЧживЊЕФЛЏЙЄдСЯЁЃПЦбЇМвгУЬЋбєФмЗжНтЫЎЩњГЩЕФЧтЦјдкДпЛЏМСзїгУЯТгы![]() ЗДгІЩњГЩМзДМЁЃвбжЊЃК
ЗДгІЩњГЩМзДМЁЃвбжЊЃК![]() ЁЂ
ЁЂ![]() КЭ
КЭ![]() ЕФШМЩеШШHЗжБ№ЮЊ
ЕФШМЩеШШHЗжБ№ЮЊ![]() ЁЂ
ЁЂ![]() КЭ
КЭ![]() ЁЃЧыЛиД№ЯТСаЮЪЬтЃК
ЁЃЧыЛиД№ЯТСаЮЪЬтЃК
(1)гУЬЋбєФмЗжНт![]() ЫЎЯћКФЕФФмСПЪЧ________
ЫЎЯћКФЕФФмСПЪЧ________![]() ЁЃ
ЁЃ
(2)МзДМВЛЭъШЋШМЩеЩњГЩвЛбѕЛЏЬМКЭвКЬЌЫЎЕФШШЛЏбЇЗНГЬЪНЮЊ________ЁЃ
(3)![]() ДпЛЏМгЧтКЯГЩМзДМ(ЗДгІЂђ)жаАщЫцзХЗДгІЂёЕФЗЂЩњЃК
ДпЛЏМгЧтКЯГЩМзДМ(ЗДгІЂђ)жаАщЫцзХЗДгІЂёЕФЗЂЩњЃК
ЗДгІЂёЃК![]()
ЗДгІЂђЃК![]()
дкКубЙЁЂ![]() КЭ
КЭ![]() ЕФЦ№ЪМСПвЛЖЈЕФЬѕМўЯТЃЌ
ЕФЦ№ЪМСПвЛЖЈЕФЬѕМўЯТЃЌ![]() ЦНКтзЊЛЏТЪКЭЦНКтЪБ
ЦНКтзЊЛЏТЪКЭЦНКтЪБ![]() ЕФбЁдёадЫцЮТЖШЕФБфЛЏШчЭМЁЃЦфжаЃК
ЕФбЁдёадЫцЮТЖШЕФБфЛЏШчЭМЁЃЦфжаЃК![]() ЕФбЁдёад
ЕФбЁдёад![]()
ЂйЮТЖШИпгк300ЁцЃЌ![]() ЦНКтзЊЛЏТЪЫцЮТЖШЩ§ИпЖјЩЯЩ§ЕФдвђЪЧ_________ЁЃ
ЦНКтзЊЛЏТЪЫцЮТЖШЩ§ИпЖјЩЯЩ§ЕФдвђЪЧ_________ЁЃ
Ђк220ЁцЪБЃЌдкДпЛЏМСзїгУЯТ![]() гы
гы![]() ЗДгІвЛЖЮЪБМфКѓЃЌВтЕУ
ЗДгІвЛЖЮЪБМфКѓЃЌВтЕУ![]() ЕФбЁдёадЮЊ48%(ЭМжаAЕу)ЁЃВЛИФБфЗДгІЪБМфКЭЮТЖШЃЌвЛЖЈФмЬсИп
ЕФбЁдёадЮЊ48%(ЭМжаAЕу)ЁЃВЛИФБфЗДгІЪБМфКЭЮТЖШЃЌвЛЖЈФмЬсИп![]() бЁдёадЕФДыЪЉга_________________(аДГіСНЕу)ЁЃ
бЁдёадЕФДыЪЉга_________________(аДГіСНЕу)ЁЃ
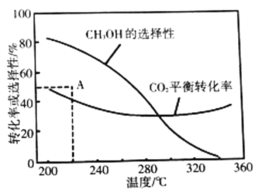
(4)дкЬхЛ§ЮЊ![]() ЕФУмБеШнЦїжаГфШы
ЕФУмБеШнЦїжаГфШы![]() КЭ
КЭ![]() ЗЂЩњЗДгІЂђЃЌЕНЦНКтЪБЧтЦјЕФзЊЛЏТЪЮЊ25%ЃЌЧѓИУЗДгІЕФЦНКтГЃЪ§K=________ЁЃ(НсЙћБЃСєЖўЮЛгааЇЪ§зж)
ЗЂЩњЗДгІЂђЃЌЕНЦНКтЪБЧтЦјЕФзЊЛЏТЪЮЊ25%ЃЌЧѓИУЗДгІЕФЦНКтГЃЪ§K=________ЁЃ(НсЙћБЃСєЖўЮЛгааЇЪ§зж)
(5)баОПжЄЪЕЃЌ![]() вВПЩдкСђЫсШмвКжагУЖшадЕчМЋЕчНтЩњГЩМзДМЃЌЩњГЩМзДМЕФЕчМЋЗДгІЪНЮЊ__________ЃЌСэвЛМЋЕчНтВњЮяЪЧ________________ЁЃ
вВПЩдкСђЫсШмвКжагУЖшадЕчМЋЕчНтЩњГЩМзДМЃЌЩњГЩМзДМЕФЕчМЋЗДгІЪНЮЊ__________ЃЌСэвЛМЋЕчНтВњЮяЪЧ________________ЁЃ
ЁОД№АИЁП571.6 ![]() ЗДгІЂёЕФ
ЗДгІЂёЕФ![]() ЃЌЗДгІЂђЕФ
ЃЌЗДгІЂђЕФ![]() ЃЌЮТЖШЩ§ИпЪЙ
ЃЌЮТЖШЩ§ИпЪЙ![]() зЊЛЏЮЊ
зЊЛЏЮЊ![]() ЕФЦНКтзЊЛЏТЪЩЯЩ§ЃЌЪЙ
ЕФЦНКтзЊЛЏТЪЩЯЩ§ЃЌЪЙ![]() зЊЛЏЮЊ
зЊЛЏЮЊ![]() ЕФЦНКтзЊЛЏТЪЯТНЕЃЌЧвЩЯЩ§ЗљЖШГЌЙ§ЯТНЕЗљЖШ діДѓбЙЧПЃЌЪЙгУЖдЗДгІЂђДпЛЏЛюадИќИпЕФДпЛЏМС 0.0062
ЕФЦНКтзЊЛЏТЪЯТНЕЃЌЧвЩЯЩ§ЗљЖШГЌЙ§ЯТНЕЗљЖШ діДѓбЙЧПЃЌЪЙгУЖдЗДгІЂђДпЛЏЛюадИќИпЕФДпЛЏМС 0.0062 ![]()
![]()
ЁОНтЮіЁП
ЃЈ1ЃЉЧтЦјЕФШМЩеШШПЩжЊЫЎЗжНтЮќЪеЕФФмСПЃЌШЛКѓРћгУЛЏбЇМЦСПЪ§гыЗДгІШШЕФЙиЯЕРДМЦЫуЃЛ
ЃЈ2ЃЉCOКЭCH3OHЕФШМЩеШШИХФюЯШЪщаДШШЗНГЬЪНЃЌдйРћгУИЧЫЙЖЈТЩРДЗжЮіМзДМВЛЭъШЋШМЩеЩњГЩвЛбѕЛЏЬМКЭвКЬЌЫЎЕФШШЛЏбЇЗНГЬЪНЃЛ
ЃЈ3ЃЉЂйИљОнЬтИЩаХЯЂЃЌЗДгІЂёЕФ![]() ЃЌЗДгІЂђЕФ
ЃЌЗДгІЂђЕФ![]() ЃЌЗжЮіЮТЖШЖдЗДгІЂёКЭЗДгІЂђЕФЦНКтвЦЖЏЧщПіМДПЩЃЛ
ЃЌЗжЮіЮТЖШЖдЗДгІЂёКЭЗДгІЂђЕФЦНКтвЦЖЏЧщПіМДПЩЃЛ
ЂкИљОн![]() ЕФбЁдёад
ЕФбЁдёад![]() ЕФЖЈвхЃЌЮТЖШВЛФмИФБфЃЌжЛФмИФБфбЙЧПКЭХЈЖШЃЌЗжЮідіДѓH2ЕФХЈЖШКЭдіДѓбЙЧПЃЌЖдЗДгІЂёКЭЗДгІЂђЦНКтЕФгАЯьЃЌвВПЩЭЈЙ§ДпЛЏМСЕФбЁдёадРДПижЦЗДгІЂђКЭЗДгІЂёЕФЗЂЩњЃЛ
ЕФЖЈвхЃЌЮТЖШВЛФмИФБфЃЌжЛФмИФБфбЙЧПКЭХЈЖШЃЌЗжЮідіДѓH2ЕФХЈЖШКЭдіДѓбЙЧПЃЌЖдЗДгІЂёКЭЗДгІЂђЦНКтЕФгАЯьЃЌвВПЩЭЈЙ§ДпЛЏМСЕФбЁдёадРДПижЦЗДгІЂђКЭЗДгІЂёЕФЗЂЩњЃЛ
(4)ИљОнЬтИЩаХЯЂЃЌНјааШ§ЖЮЪНМЦЫуПЩжЊЃК![]()
 ЃЌДњШыЦНКтГЃЪ§БэДяЪНЧѓГіИУЗДгІЕФЦНКтГЃЪ§ЃЛ
ЃЌДњШыЦНКтГЃЪ§БэДяЪНЧѓГіИУЗДгІЕФЦНКтГЃЪ§ЃЛ
(5)ЗжЮіИУЙ§ГЬжаЬМЕФЛЏКЯМлгЩ+4МлНЕЕЭЮЊ-2МлЗЂЩњЛЙдЗДгІЃЌЙЪЩњГЩМзДМдквѕМЋЩЯЗЂЩњЃЌЧвЕчНтжЪЪЧСђЫсШмвКЃЌЙЪЦфЕчМЋЗДгІЪНЮЊ![]() ЃЌСэвЛМЋМДбєМЋЃЌбєМЋЗЂЩњбѕЛЏЗДгІЃЌЙЪЕчМЋЗНГЬЪНЮЊЃК
ЃЌСэвЛМЋМДбєМЋЃЌбєМЋЗЂЩњбѕЛЏЗДгІЃЌЙЪЕчМЋЗНГЬЪНЮЊЃК![]() ЃЌЙЪЕчНтВњЮяЮЊO2ЁЃ
ЃЌЙЪЕчНтВњЮяЮЊO2ЁЃ
ЂёЃЎЃЈ1ЃЉгЩH2ЃЈgЃЉЕФШМЩеШШЁїHЮЊ-285.8kJmol-1жЊЃЌ1molH2ЃЈgЃЉЭъШЋШМЩеЩњГЩ1molH2OЃЈlЃЉЗХГіШШСП285.8kJЃЌМДЗжНт1mol H2OЃЈlЃЉЮЊ1mol H2ЃЈgЃЉЯћКФЕФФмСПЮЊ285.8kJЃЌдђЗжНт2mol H2OЃЈlЃЉЯћКФЕФФмСПЮЊ285.8kJЁС2=571.6kJЃЌЙЪД№АИЮЊЃК571.6 kJЃЛ
ЃЈ2ЃЉгЩCOЃЈgЃЉКЭCH3OHЃЈlЃЉЕФШМЩеШШЁїHЗжБ№ЮЊ-283.0kJmol-1КЭ-726.5kJmol-1ЃЌдђ
ЂйCOЃЈgЃЉ+1/2O2ЃЈgЃЉ=CO2ЃЈgЃЉЁїH=-283.0kJmol-1
ЂкCH3OHЃЈlЃЉ+3/2O2ЃЈgЃЉ=CO2ЃЈgЃЉ+2H2OЃЈlЃЉЁї
гЩИЧЫЙЖЈТЩПЩжЊгУЂк-ЂйЕУЗДгІCH3OHЃЈlЃЉ+O2ЃЈgЃЉ=COЃЈgЃЉ+2 H2OЃЈlЃЉЃЌИУЗДгІЕФЗДгІШШЁїH=-726.5kJmol-1-ЃЈ-283.0kJmol-1ЃЉ=-443.5kJmol-1ЃЌ
ЙЪД№АИЮЊЃКCH3OHЃЈlЃЉ+O2ЃЈgЃЉ=COЃЈgЃЉ+2 H2OЃЈlЃЉЁїH=-443.5kJmol-1ЃЛ
ЃЈ3ЃЉЂйгЩЬтИЩПЩжЊЃКЗДгІЂёЕФ![]() ЃЌЙЪЮТЖШЩ§ИпЪЙ
ЃЌЙЪЮТЖШЩ§ИпЪЙ![]() зЊЛЏЮЊ
зЊЛЏЮЊ![]() ЕФЦНКтзЊЛЏТЪЩЯЩ§ЃЛЖјЗДгІЂђЕФ
ЕФЦНКтзЊЛЏТЪЩЯЩ§ЃЛЖјЗДгІЂђЕФ![]() ЃЌЙЪЮТЖШЩ§ИпЪЙ
ЃЌЙЪЮТЖШЩ§ИпЪЙ![]() зЊЛЏЮЊ
зЊЛЏЮЊ![]() ЕФЦНКтзЊЛЏТЪЯТНЕЃЌЕЋгЩгкЩЯЩ§ЗљЖШГЌЙ§ЯТНЕЗљЖШЃЌзюжеЕМжТCO2ЕФЦНКтзЊЛЏТЪЩЯЩ§ЃЌЙЪД№АИЮЊЃКЗДгІЂёЕФ
ЕФЦНКтзЊЛЏТЪЯТНЕЃЌЕЋгЩгкЩЯЩ§ЗљЖШГЌЙ§ЯТНЕЗљЖШЃЌзюжеЕМжТCO2ЕФЦНКтзЊЛЏТЪЩЯЩ§ЃЌЙЪД№АИЮЊЃКЗДгІЂёЕФ![]() ЃЌЗДгІЂђЕФ
ЃЌЗДгІЂђЕФ![]() ЃЌЮТЖШЩ§ИпЪЙ
ЃЌЮТЖШЩ§ИпЪЙ![]() зЊЛЏЮЊ
зЊЛЏЮЊ![]() ЕФЦНКтзЊЛЏТЪЩЯЩ§ЃЌЪЙ
ЕФЦНКтзЊЛЏТЪЩЯЩ§ЃЌЪЙ![]() зЊЛЏЮЊ
зЊЛЏЮЊ![]() ЕФЦНКтзЊЛЏТЪЯТНЕЃЌЧвЩЯЩ§ЗљЖШГЌЙ§ЯТНЕЗљЖШЃЛ
ЕФЦНКтзЊЛЏТЪЯТНЕЃЌЧвЩЯЩ§ЗљЖШГЌЙ§ЯТНЕЗљЖШЃЛ
ЂкИљОн![]() ЕФбЁдёад
ЕФбЁдёад![]() ЕФЖЈвхЃЌЯыЬсИпЦфбЁдёадЃЌгІИУЪЙЕУЦНКтЯђЩњГЩИќЖрCH3OHЕФЗНЯђвЦЖЏЃЌЮТЖШВЛФмИФБфЃЌжЛФмИФБфбЙЧПКЭХЈЖШЃЌШєдіДѓH2ЕФХЈЖШЃЌЗДгІЂёвВЯђе§ЯђвЦЖЏЃЌЙЪCH3OHЕФбЁдёадВЛвЛЖЈЬсИпЃЌЕЋЪЧдіДѓбЙЧПЃЌЗДгІЂёЦНКтВЛвЦЖЏЃЌЗДгІЂђЦНКте§ЯђвЦЖЏЃЌЙЪCH3OHЕФбЁдёадвЛЖЈЬсИпЃЌЭЌЪБвВПЩЭЈЙ§ИФБфДпЛЏМСРДПижЦЗДгІЂђКЭЗДгІЂёЕФЗЂЩњЃЌбАеввЛжжЖдЗДгІЂђДпЛЏЛюадИќИпЕФДпЛЏМСРДЬсИпЦфбЁдёадЃЌЙЪД№АИЮЊЃКдіДѓбЙЧПЃЌЪЙгУЖдЗДгІЂђДпЛЏЛюадИќИпЕФДпЛЏМСЃЛ
ЕФЖЈвхЃЌЯыЬсИпЦфбЁдёадЃЌгІИУЪЙЕУЦНКтЯђЩњГЩИќЖрCH3OHЕФЗНЯђвЦЖЏЃЌЮТЖШВЛФмИФБфЃЌжЛФмИФБфбЙЧПКЭХЈЖШЃЌШєдіДѓH2ЕФХЈЖШЃЌЗДгІЂёвВЯђе§ЯђвЦЖЏЃЌЙЪCH3OHЕФбЁдёадВЛвЛЖЈЬсИпЃЌЕЋЪЧдіДѓбЙЧПЃЌЗДгІЂёЦНКтВЛвЦЖЏЃЌЗДгІЂђЦНКте§ЯђвЦЖЏЃЌЙЪCH3OHЕФбЁдёадвЛЖЈЬсИпЃЌЭЌЪБвВПЩЭЈЙ§ИФБфДпЛЏМСРДПижЦЗДгІЂђКЭЗДгІЂёЕФЗЂЩњЃЌбАеввЛжжЖдЗДгІЂђДпЛЏЛюадИќИпЕФДпЛЏМСРДЬсИпЦфбЁдёадЃЌЙЪД№АИЮЊЃКдіДѓбЙЧПЃЌЪЙгУЖдЗДгІЂђДпЛЏЛюадИќИпЕФДпЛЏМСЃЛ
(4)дкЬхЛ§ЮЊ![]() ЕФУмБеШнЦїжаГфШы
ЕФУмБеШнЦїжаГфШы![]() КЭ
КЭ![]() ЗЂЩњЗДгІЂђЃЌЕНЦНКтЪБЧтЦјЕФзЊЛЏТЪЮЊ25%ЃЌИљОнШ§ЖЮЪНМЦЫуПЩжЊЃК
ЗЂЩњЗДгІЂђЃЌЕНЦНКтЪБЧтЦјЕФзЊЛЏТЪЮЊ25%ЃЌИљОнШ§ЖЮЪНМЦЫуПЩжЊЃК![]()
 ЃЌИУЗДгІЕФЦНКтГЃЪ§
ЃЌИУЗДгІЕФЦНКтГЃЪ§ ЃЌЙЪД№АИЮЊЃК0.0062ЃЛ
ЃЌЙЪД№АИЮЊЃК0.0062ЃЛ
(5)баОПжЄЪЕЃЌ![]() вВПЩдкСђЫсШмвКжагУЖшадЕчМЋЕчНтЩњГЩМзДМЃЌИУЙ§ГЬжаЬМЕФЛЏКЯМлгЩ+4МлНЕЕЭЮЊ-2МлЗЂЩњЛЙдЗДгІЃЌЙЪЩњГЩМзДМдквѕМЋЩЯЗЂЩњЃЌЧвЕчНтжЪЪЧСђЫсШмвКЃЌЙЪЦфЕчМЋЗДгІЪНЮЊ
вВПЩдкСђЫсШмвКжагУЖшадЕчМЋЕчНтЩњГЩМзДМЃЌИУЙ§ГЬжаЬМЕФЛЏКЯМлгЩ+4МлНЕЕЭЮЊ-2МлЗЂЩњЛЙдЗДгІЃЌЙЪЩњГЩМзДМдквѕМЋЩЯЗЂЩњЃЌЧвЕчНтжЪЪЧСђЫсШмвКЃЌЙЪЦфЕчМЋЗДгІЪНЮЊ![]() ЃЌСэвЛМЋМДбєМЋЃЌбєМЋЗЂЩњбѕЛЏЗДгІЃЌЙЪЕчМЋЗНГЬЪНЮЊЃК
ЃЌСэвЛМЋМДбєМЋЃЌбєМЋЗЂЩњбѕЛЏЗДгІЃЌЙЪЕчМЋЗНГЬЪНЮЊЃК![]() ЃЌЙЪЕчНтВњЮяЮЊO2ЃЌЙЪД№АИЮЊЃК
ЃЌЙЪЕчНтВњЮяЮЊO2ЃЌЙЪД№АИЮЊЃК![]() ЃЌO2ЁЃ
ЃЌO2ЁЃ


 ПЦбЇЪЕбщЛюЖЏВсЯЕСаД№АИ
ПЦбЇЪЕбщЛюЖЏВсЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП[ЛЏбЇЁЊЁЊбЁао3ЃКЮяжЪНсЙЙгыаджЪ]
аПдкЙЄвЕжагаживЊзїгУЃЌвВЪЧШЫЬхБиашЕФЮЂСПдЊЫиЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉZnдзгКЫЭтЕчзгХХВМЪНЮЊ________________ЁЃ
ЃЈ2ЃЉЛЦЭЪЧШЫРрзюдчЪЙгУЕФКЯН№жЎвЛЃЌжївЊгЩZnКЭCuзщГЩЁЃЕквЛЕчРыФмЂё1ЃЈZnЃЉ_______Ђё1ЃЈCu)(ЬюЁАДѓгкЁБЛђЁАаЁгкЁБ)ЁЃдвђЪЧ________________ЁЃ
ЃЈ3ЃЉZnF2ОпгаНЯИпЕФШлЕуЃЈ872 Ёц)ЃЌЦфЛЏбЇМќРраЭЪЧ_________ЃЛZnF2ВЛШмгкгаЛњШмМСЖјZnCl2ЁЂZnBr2ЁЂZnI2ФмЙЛШмгкввДМЁЂввУбЕШгаЛњШмМСЃЌдвђЪЧ________________ЁЃ
ЃЈ4ЃЉЁЖжаЛЊБОВнЁЗЕШжавНЕфМЎжаЃЌМЧдиСЫТЏИЪЪЏЃЈZnCO3ЃЉШывЉЃЌПЩгУгкжЮСЦЦЄЗєбзжЂЛђБэУцДДЩЫЁЃZnCO3жаЃЌвѕРызгПеМфЙЙаЭЮЊ________________ЃЌCдзгЕФдгЛЏаЮЪНЮЊ________________ЁЃ
ЃЈ5ЃЉН№ЪєZnОЇЬхжаЕФдзгЖбЛ§ЗНЪНШчЭМЫљЪОЃЌетжжЖбЛ§ЗНЪНГЦЮЊ_______________ЁЃСљРтжљЕзБпБпГЄЮЊa cmЃЌИпЮЊc cmЃЌАЂЗќМгЕТТоГЃЪ§ЕФжЕЮЊNAЃЌZnЕФУмЖШЮЊ________________gЁЄcmЃ3ЃЈСаГіМЦЫуЪНЃЉЁЃ

ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЙигкИїЭМЯѓЕФНтЪЭЛђНсТлВЛе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ

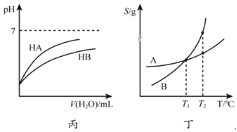
A.гЩМзПЩжЊЃКЪЙгУДпЛЏМСНЕЕЭСЫЗДгІЕФЛюЛЏФм
B.гЩввПЩжЊЃКЖдгкКуЮТКуШнЬѕМўЯТЕФЗДгІ2NO2ЃЈgЃЉN2O4ЃЈgЃЉЃЌAЕуЮЊЦНКтзДЬЌ
C.гЩБћПЩжЊЃКЭЌЮТЖШЁЂЭЌХЈЖШЕФNaAШмвКгыNaBШмвКЯрБШЃЌЦфpHЧАепаЁгкКѓеп
D.гЩЖЁПЩжЊЃКНЋT1ЁцЕФAЁЂBБЅКЭШмвКЩ§ЮТжСT2ЁцЪБЃЌAгыBШмвКЕФжЪСПЗжЪ§ЯрЕШ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПюбПѓЙЄвЕжаЕФСђЫсЫсадЗЯЫЎИЛКЌTiЁЂFeЕШдЊЫиЃЌЦфзлКЯРћгУШчЯТЃК

вбжЊЃКTiO2+взЫЎНтЃЌжЛФмДцдкгкЧПЫсадШмвКжаЁЃ
ЃЈ1ЃЉTiO2+юбЕФЛЏКЯМлЮЊ________________________ЁЃ
ЃЈ2ЃЉВНжшЂёжаМьбщюбПѓЗЯЫЎжаМгШыЬњаМЪЧЗёзуСПЕФЪдМСЪЧ________________________ЁЃ
ЃЈ3ЃЉВйзїaЪЧеєЗЂХЈЫѕЁЂРфШДНсОЇЁЂ______________________________________________ЁЃ
ЃЈ4ЃЉВНжшЂѓжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ________________________ЃЛЗДгІЮТЖШвЛАуашПижЦдк35ЁцвдЯТЃЌЦфФПЕФЪЧ____________________________________ЁЃ
ЃЈ5ЃЉвбжЊKsp=[FeЃЈOHЃЉ2] = 8ЁС10-16ЁЃВНжшЂѓжаЃЌFeCO3ДяЕНШмНтЦНКтЪБЃЌШєЪвЮТЯТВтЕУШмвКЕФpHЮЊ8.5ЃЌ cЃЈFe2+ЃЉ = 1ЁС10-6mol/LЁЃЪдХаЖЯЫљЕУЕФFeCO3жа________ЃЈЬюЁАгаЁБЛђЁАУЛгаЁБЃЉFeЃЈOHЃЉ2ЃЛВНжшЂєжаЃЌЮЊСЫЕУЕННЯЮЊДПОЛЕФFe2O3ЃЌГ§СЫЪЪЕБЕФЮТЖШЭтЃЌЛЙашвЊВЩШЁЕФДыЪЉЪЧ_________________ЁЃ
ЃЈ6ЃЉЯђЁАИЛКЌTiO2+ШмвКЁБжаМгШыNa2CO3ЗлФЉвзЕУЕНЙЬЬхTiO2 nH2OЁЃЧыНсКЯдРэКЭЛЏбЇгУгяНтЪЭЦфдвђ_________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШМУКбЬЦјжаЕФ![]() ПЩгУСЌЖўбЧСђЫсИљ(
ПЩгУСЌЖўбЧСђЫсИљ(![]() )ЮЊУННщДІРэЪЙЦфзЊЛЏЮЊ
)ЮЊУННщДІРэЪЙЦфзЊЛЏЮЊ![]() ЃЌЦфдРэШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ( )
ЃЌЦфдРэШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ( )

A.ШМУКбЬЦјжа![]() ЕФДІРэНіРћгУЕФЪЧЕчНтдРэ
ЕФДІРэНіРћгУЕФЪЧЕчНтдРэ
B.вѕМЋЧјЕФЕчМЋЗДгІЪНЮЊ![]()
C.ШєЭЈЕчЙ§ГЬжаЮќЪе![]() (БъзМзДПіЯТ)ЃЌдђбєМЋПЩвдВњЩњ
(БъзМзДПіЯТ)ЃЌдђбєМЋПЩвдВњЩњ![]() ЦјЬх
ЦјЬх
D.ЗДгІвЛЖЮЪБМфКѓЃЌ![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЏКЯЮяGЪЧвЛжжвЉЮяКЯГЩжаМфЬхЃЌЦфКЯГЩТЗЯпШчЭМЃК
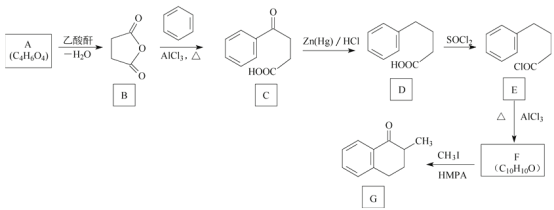
вбжЊAЗжзгжажЛКЌгавЛжжЙйФмЭХЧвФмгы![]() ЗДгІЩњГЩ
ЗДгІЩњГЩ![]() ЁЃЛиД№ЯТСаЮЪЬтЃК
ЁЃЛиД№ЯТСаЮЪЬтЃК
(1)AЕФЛЏбЇУћГЦЪЧ___________ЁЃ
(2)CжаЕФЙйФмЭХУћГЦЪЧ___________ЁЃ
(3)DЩњГЩEЕФЗДгІРраЭЪЧ___________ЁЃ
(4)FЕФНсЙЙМђЪНЪЧ___________ЁЃ
(5)AгыввЖўДМдкДпЛЏМСзїгУЯТЗДгІЩњГЩПЩЩњЮяНЕНтаЭОлѕЅPESЃЌИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_________ЁЃ
(6)XЪЧGЕФЭЌЗжвьЙЙЬхЃЌТњзуЯТСаЬѕМўЕФXЙВга___________жж(ВЛПМТЧСЂЬхвьЙЙ)
ЂйКЌБНЛЗЧвБНЛЗЩЯжЛгаШ§ИіШЁДњЛљЃЛ
ЂкКЌШЉЛљЧвгыБНЛЗжБНгЯрСЌЃЛ
ЂлГ§БНЛЗЭтВЛКЌЦфЫћЛЗзДНсЙЙЁЃ
ШєЂйИФГЩКЌБНЛЗЧвБНЛЗЩЯжЛгаЖўИіШЁДњЛљЃЌЦфЫћЬѕМўВЛБфЃЌЦфжаКЫДХЙВеёЧтЦзга5зщЗхЃЌУцЛ§БШЮЊ6ЁУ2ЁУ2ЁУ1ЁУ1ЕФЪЧ________(аДНсЙЙМђЪН)ЁЃ
(7)гЩБНКЭМзБНжЦБИ![]() ЕФКЯГЩТЗЯпШчЯТЃК
ЕФКЯГЩТЗЯпШчЯТЃК
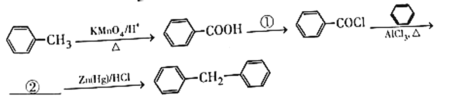
ЬюаДЃКЂй___________Ђк___________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖЬжмЦкжїзхдЊЫиWЁЂXЁЂYЁЂZЃЌMЪЧWЕФзюИпМлбѕЛЏЮяЖдгІЕФЫЎЛЏЮяЃЌГЃЮТЯТЃЌ0.01 molLЉ1 MШмвКЕФpHЃН12ЃЌXЁЂYЁЂZЕФЕЅжЪeЁЂfЁЂgдкЭЈГЃзДЬЌЯТОљЮЊЦјЬЌЃЌВЂгаШчЭМЫљЪОЕФзЊЛЏЙиЯЕ(ЗДгІЬѕМўТдШЅ)ЁЃдкЫЋдзгЕЅжЪЗжзгжаЃЌfЗжзгКЌЙВгУЕчзгЖдЪ§зюЖрЃЌ1ИіввЗжзгКЌ10ИіЕчзгЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ(ЁЁЁЁ)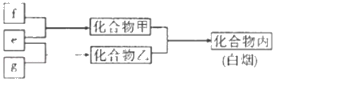
A.МђЕЅРызгАыОЖЃКZЃОYЃОW
B.XФмЗжБ№гыWЁЂYЁЂZзщГЩЙВМлЛЏКЯЮя
C.ЛЏКЯЮяБћФмвжжЦЫЎЕчРы
D.XгыYдЊЫиаЮГЩЕФзюМђЕЅЕФЦјЬЌЧтЛЏЮяЪЧМЋадЗжзг
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЭМЪОгыЖдгІЕФа№ЪіЯрЗћКЯЕФЪЧЃЈ ЃЉ
A.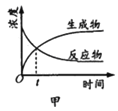 ЭММзБэЪОФГПЩФцЗДгІжаЮяжЪХЈЖШЫцЪБМфЕФБфЛЏЃЌЗДгІдкtЪБПЬДяЕНЦНКтзДЬЌ
ЭММзБэЪОФГПЩФцЗДгІжаЮяжЪХЈЖШЫцЪБМфЕФБфЛЏЃЌЗДгІдкtЪБПЬДяЕНЦНКтзДЬЌ
B.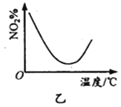 ЭМввБэЪОNO2дкКуШнУмБеШнЦїжаЗЂЩњЗДгІЃК2NO2(g)
ЭМввБэЪОNO2дкКуШнУмБеШнЦїжаЗЂЩњЗДгІЃК2NO2(g) ![]() N2O4(g)ЃЌNO2ЬхЛ§ЗжЪ§гыЮТЖШЕФБфЛЏЧњЯпЃЌдђИУЗДгІЕФе§ЗДгІЁїH<0
N2O4(g)ЃЌNO2ЬхЛ§ЗжЪ§гыЮТЖШЕФБфЛЏЧњЯпЃЌдђИУЗДгІЕФе§ЗДгІЁїH<0
C.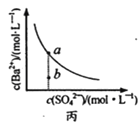 ЭМБћБэЪОФГЮТЖШЪБЃЌBaSO4дкЫЎжаЕФШмНтЦНКтЧњЯпЃЌеєЗЂЫЎПЩЪЙШмвКгЩbЕуБфЕНaЕу
ЭМБћБэЪОФГЮТЖШЪБЃЌBaSO4дкЫЎжаЕФШмНтЦНКтЧњЯпЃЌеєЗЂЫЎПЩЪЙШмвКгЩbЕуБфЕНaЕу
D.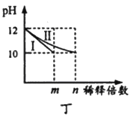 ЭМЖЁБэЪОЗжБ№ЯЁЪЭ10 mL pHОљЮЊ12ЕФNaOHКЭNH3H2OШмвКЪБpHЕФБфЛЏЃЌЧњЯпIБэЪОNH3H2OШмвКЃЌn>100
ЭМЖЁБэЪОЗжБ№ЯЁЪЭ10 mL pHОљЮЊ12ЕФNaOHКЭNH3H2OШмвКЪБpHЕФБфЛЏЃЌЧњЯпIБэЪОNH3H2OШмвКЃЌn>100
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈЬѕМўЯТЃЌЭЈЙ§ЯТСаЗДгІПЩЪЕЯжШМУКбЬЦјжаСђЕФЛиЪеЃКSO2(g)+2CO(g)![]() 2CO2(g)+S(l)+QЃЈQЉ0ЃЉЃЌШєЗДгІдкКуШнУмБеШнЦїжаНјааЃЌЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
2CO2(g)+S(l)+QЃЈQЉ0ЃЉЃЌШєЗДгІдкКуШнУмБеШнЦїжаНјааЃЌЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.ЦНКтЧАЃЌЫцзХЗДгІЕФНјааЃЌШнЦїФкбЙЧПЪМжеВЛБф
B.ЦНКтЪБЃЌЦфЫќЬѕМўВЛБфЃЌЗжРыГіСђЃЌе§ЗДгІЫйТЪМгПь
C.ДяЕНЦНКтЪБЃЌSO2ЁЂCOЁЂCO2ЕФЦНКтХЈЖШвЛЖЈЮЊ1ЃК2ЃК2
D.ЦНКтЪБЃЌЦфЫћЬѕМўВЛБфЃЌЩ§ИпЮТЖШSO2ЕФзЊЛЏТЪНЕЕЭ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com