
【题目】在一定体积的密闭容器中,进行如下化学反应:
CO(g)+H2O(g) ![]() CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(选填“吸热”、“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是;
A.容器中压强不变
B.混合气体中c(CO)不变
C.v逆(H2)=v正(H2O)
D.c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,在此温度下,若该容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,这状态(是或否)处于平衡状态?若不是,反应向哪个方向进行? . (选填“向正反应方向”、“向逆反应方向”).
(4)若830℃时,向容器中充入lmolCO、5molH2O,反应达到平衡后,CO的转化率为 .
【答案】
(1)![]() ;放热
;放热
(2)BC
(3)否;向逆反应方向
(4)83.3%(或83%,或5/6)
【解析】解:(1)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比,但不包含固体和纯液体,所以该反应化学平衡常数K= ![]() ;升高温度平衡向吸热方向移动,根据表中数据知,升高温度化学平衡常数减小,说明平衡逆向移动,则正反应是放热反应,
;升高温度平衡向吸热方向移动,根据表中数据知,升高温度化学平衡常数减小,说明平衡逆向移动,则正反应是放热反应,
所以答案是: ![]() ;放热;(2)A.该反应前后气体物质的量不变,所以反应是否达到平衡状态容器中压强都不变,所以不能判断平衡状态,故错误;
;放热;(2)A.该反应前后气体物质的量不变,所以反应是否达到平衡状态容器中压强都不变,所以不能判断平衡状态,故错误;
B.混合气体中c(CO)不变时,正逆反应速率相等,反应达到平衡状态,故正确;
C.v逆(H2)=v正(H2O)=v正(H2),正逆反应速率相等,反应达到平衡状态,故正确;
D.c(CO2)=c(CO)时该反应可能达到平衡状态也可能没有达到平衡状态,与反应物初始量及转化率有关,所以不能判断平衡状态,故错误;
故选BC;(3)因为该反应中各气体计量数都是1,所以化学平衡常数也等于生成物物质的量之积与反应物物质的量之积的比,830℃时,化学平衡常数K=1.0,若该容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,该体系中浓度商= ![]() =1.07>1,该反应没有达到平衡状态,要使反应达到平衡状态,应该向逆反应方向移动,
=1.07>1,该反应没有达到平衡状态,要使反应达到平衡状态,应该向逆反应方向移动,
所以答案是:否;向逆反应方向;(4)该温度下化学平衡常数K为1.0,设参加反应的n(CO)=xmol,根据方程式知,参加反应的n(H2O)=n(H2)=n(CO2)=n(CO)=xmol,K= ![]() ,x=
,x= ![]() ,
,
转化率= ![]() ×100%=
×100%= ![]() =.83.3%(或83%,或5/6),
=.83.3%(或83%,或5/6),
所以答案是:83.3%(或83%,或5/6).
【考点精析】根据题目的已知条件,利用化学平衡状态本质及特征和化学平衡的计算的相关知识可以得到问题的答案,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】完成下列实验所需的装置或仪器都正确的是( )
A.分离植物油和氯化钠溶液: 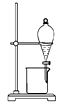
B.除去氯化钠晶体中混有的I2晶体: 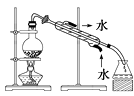
C.分离CCl4中的Br2: 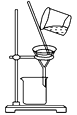
D.除去CO2气体中的HCl气体: 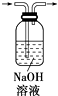
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法正确的是( ) 
A.b极为正极,发生氧化反应
B.外电路中电子的移动方向为:b→a
C.质子通过交换膜从b极区移向a极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0 g质量分数为14.0%的KNO3溶液与30.0 g质量分数为24.0%的KNO3溶液混合,得到的密度为1.15 g/cm3的混合溶液。计算(写出计算步骤):
(1)混合后溶液的质量分数。
(2)混合后溶液的物质的量浓度(计算结果保留两位小数,下同)。
(3)在1 000 g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH=5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的Cl原子和被还原的Cl原子的物质的量之比为5∶1
C.Cl2既做氧化剂又做还原剂
D.氧化剂得电子数与还原剂失电子数之比为5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热条件下,将24.0gCuO和Fe2O3的混合物与足量的CO完全反应,并将反应后的气体全部通入到足量的澄清石灰水中,得到白色沉淀40.0g.下列有关叙述中不正确的是( )
A.原混合物中CuO和Fe2O3的物质的量的比为1:1
B.参加反应的CO的质量为11.2g
C.原混合物中Fe元素的质量为5.6g
D.原混合物中CuO的质量分数约为33.3%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化剂与还原剂的判断正确的是( )
A.反应CH4+2O2![]() CO2+2H2O中,O2是氧化剂,CH4是还原剂
CO2+2H2O中,O2是氧化剂,CH4是还原剂
B.反应Cl2+2NaOH=NaClO+NaCl+H2O中,Cl2是氧化剂,NaOH是还原剂
C.反应MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O中,HCl是氧化剂,MnO2是还原剂
MnCl2+Cl2↑+2H2O中,HCl是氧化剂,MnO2是还原剂
D.反应2Na+2H2O=2NaOH+H2↑中,H2O既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地壳中含量第一和第三的两元素形成的化合物不具有的性质是( )
A.熔点很高B.与铁在高温下发生放热反应
C.能溶于氢氧化钠溶液D.熔融后可以导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的可再生能源.
(1)2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=a kJ/mol
CO(g)+2H2(g)=CH3OH(g)△H=b kJ/mol
写出由CH4和O2制取CH3OH(g)的热化学方程式: .
(2)甲图是反应时CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线.从反应开始至达到平衡时,用H2表示的反应速率v(H2)= . 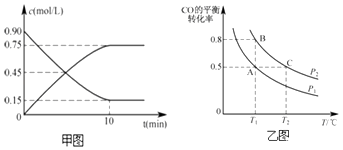
(3)在一容积可变的密闭容器中充入10mol CO和20mol H2 , 发生上述反应并达到平衡,CO的平衡转化率随温度(T)、压强(P)的变化曲线如乙图所示.
能判断该反应达到化学平衡状态的是(填选项字母).
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.H2的转化率和CO的转化率相等
D.混合气体的平均相对分子质量不再改变
(4)以甲醇为燃料,O2为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极).若KOH溶液足量,写出燃料电池负极的电极反应式:
(5)如图所示,以甲醇燃料电池作为电源实现下列电解过程.乙池中发生反应的离子方程式为 . 当甲池中增重16g时,丙池中理论上产生沉淀质量的最大值为g. 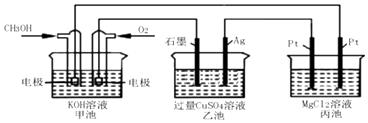
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com