
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,平衡常数增大
C.反应前H2S物质的量为7mol
D.CO的平衡转化率为80%
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
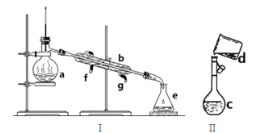
(1)写出下列仪器的名称:a._____ b.______ c.___
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是______,将仪器补充完整后进行实验的名称为___;冷凝水由___(填f或g)口通入,____口流出。现需配制250mL0.2mol/L NaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiCl3是烯烃定向聚合的催化剂、TiCl4可用于制备金属Ti。
nCH3CH=CH2![]()
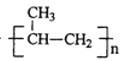
TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
TiCl4+2Mg![]() Ti+2MgCl2
Ti+2MgCl2
(1)Ti3+的基态核外电子排布式为__________。
(2)丙烯分子中,碳原子轨道杂化类型为______和____。
(3)Mg、Al、Cl第一电离能由大到小的顺序是___________。
(4)写出一种由第2周期元素组成的且与CO互为等电子体的阴离子的电子式________。
(5)TiCl3浓溶液中加入无水乙醚,并通入HCl至饱和,在乙醚层得到绿色的异构体,结构式分别是[Ti(H2O)6]Cl3、[Ti(H2O)5Cl]Cl2·H2O。1mol[Ti(H2O)6]Cl3中含有σ键的数目为______。

(6)钛酸锶具有超导性、热敏性及光敏性等优点,该晶体的晶胞中Sr位于晶胞的顶点,O位于晶胞的面心,Ti原子填充在O原子构成的正八面体空隙的中心位置,据此推测,钛酸锶的化学式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
(1)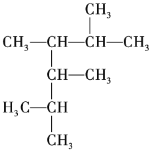 的名称为______。
的名称为______。
(2)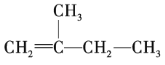 的名称为______。
的名称为______。
(3)3-甲基-2-戊烯的结构简式为______。
(4)1,3,5-三甲基苯的结构简式为______。
(5)某烷烃的相对分子质量为72,其一氯代物只有一种,该烷烃的结构简式为______。
(6)2,3-二甲基-2-丁烯的键线式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的电子式____________,结构简式____________。
(2)鉴别甲烷和乙烯的试剂是______(填序号)。
a.稀硫酸 b.溴的四氯化碳溶液 c.水 d.酸性高锰酸钾溶液
(3)下列物质中,可以通过乙烯加成反应得到的是______(填序号)。
a.CH3CH3 b.CH3CHCl2 c.CH3CH2OH d.CH3CH2Br
(4)已知 2CH3CHO+O2![]() 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示:
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示:
![]()
反应②的化学方程式为_________。 工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为_____________,反应类型是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列3种不同粒子![]() H、
H、![]() H、
H、![]() H表示______种元素,______种核素,
H表示______种元素,______种核素,![]() H、
H、![]() H、
H、![]() H互称为__________________。
H互称为__________________。
(2)有人称煤炭是“工业的粮食”,通过煤的综合利用可以获得重要化工原料,如焦炭,它是煤的______ (填“蒸馏”或“干馏”)产物,可用于________________ (填出一种用途);以煤为原料可以制得水煤气,其反应的化学方程式为________________________________。
(3)元素的电负性的大小可以作为判断元素金属性与非金属性强弱的尺度。下表列出部分短周期元素的电负性。请回答下列问题。
元素 | Al | B | Be | C | Cl | X | Li |
电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
元素 | Mg | N | Y | O | P | S | Si |
电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
①根据上表给出的数据,可知元素的电负性越大,____________(填“金属性”或“非金属性”)越强。
②推测Y 为______(填元素符号),用电子式表示X元素与Y元素的化合物的形成过程__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置进行脱硫,将硫化氢气体转化成硫沉淀。已知甲、乙池中发生的反应为(右图):下列说法正确的是
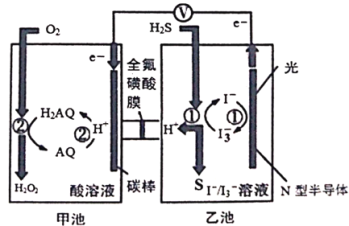
A. 甲池中得到H2O2的反应,H2O2既是氧化产物也是还原产物
B. 电路中每转移0.2mol电子,甲池溶液质量变化3.4g,乙池溶液质量保持不变
C. 光照时乙池电极上发生的反应为:H2S+I3-=3I-+S+2H+
D. 甲池中炭棒上发生的电极反应为:AQ+2H+-2e-=H2AQ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的衍生物A的化学式为C6H12O2,已知:

又知D不与Na2CO3反应,C和E均不能发生银镜反应,则A的结构可能有( )
A.2种B.3种C.4种D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向恒容的密闭容器中充入一定量的NO2(g),发生反应2NO2(g)![]() N2O4(g)△H<0。下列选项中不能作为判断反应是否达到平衡状态的因素的是
N2O4(g)△H<0。下列选项中不能作为判断反应是否达到平衡状态的因素的是
A.混合气体的平均相对分子质量B.NO2(g)的百分含量
C.容器内压强D.NO2和N2O4的反应速率之比
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com