
【题目】类推法在化学学习中经常采用,下列类推的结论正确的是()
A. 由Cl2+2KBr═2KCl+Br2所以F2也能与KBr溶液反应置换出Br2
B. 常温下,由Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,所以Fe也能与浓硝酸反应产生NO2
C. 由Cu+Cl2![]() CuCl2所以Cu+I2
CuCl2所以Cu+I2![]() CuI2
CuI2
D. 由钠保存在煤油中,所以钾也可以保存在煤油中
【答案】D
【解析】
试题A.由于F2化学性质非常活泼,可以与溶液的水发生反应产生HF和O2,因此不能与KBr溶液反应置换出Br2,错误;B. 常温下,Cu+4HNO3(浓)=Cu(NO3)2+ 2NO2↑+2H2O,但是Fe会被浓硝酸氧化产生一层致密的氧化物保护膜,阻止金属的进一步反应,即发生钝化现象,所以Fe不能与浓硝酸反应产生NO2,错误;C. Cl2的氧化性强,可以与变价金属Cu发生反应Cu+Cl2![]() CuCl2,使Cu变为高价态,但是由于I2的氧化性弱,只能把Cu氧化为第价态,所以不能发生反应Cu+I2
CuCl2,使Cu变为高价态,但是由于I2的氧化性弱,只能把Cu氧化为第价态,所以不能发生反应Cu+I2![]() CuI2,错误;D.由于Na、K密度都比煤油大,与煤油不能发生反应,所以都可以保存在煤油中,正确。
CuI2,错误;D.由于Na、K密度都比煤油大,与煤油不能发生反应,所以都可以保存在煤油中,正确。


科目:高中化学 来源: 题型:
【题目】某蓝色电解质溶液中,只可能大量存在有H+、Cu2+、CO32-、OH-、Cl-等离子,你认为一定有的离子是______________,一定没有的离子是_____________,还需进一步确认的_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一种天然产物,具有一定的除草功效。下列有关该化合物的说法错误的是

A. 分子中含有三种含氧官能团
B. 1mol该化合物最多能与4molNaOH反应
C. 既可以发生取代反应,又能够发生加成反应
D. 既能与FeCl3发生显色反应,也能和NaHCO3反应放出CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常把断裂1 mol某化学键所吸收的能量称为键能。键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(用△H表示,放热反应的△H<0,吸热反应的△H>0),△H=反应物总键能-生成物总键能。
已知:N-N键、H-H键和N-H键的键能分别记作a、b和c(单位:kJ·mol-1),合成氨反应的能量变化关系如图所示。回答下列问题:

(1)合成氨反应的化学方程式为___。
(2)NH3分解生成N2和l mol H2要____(填“吸收”或“放出”)___热量(用含a、b、c的代数式表示)kJ。
(3)事实上,反应的热量总小于理论值,原因可能是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
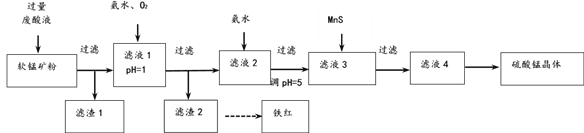
【题目】用软锰矿[主要成分MnO2,还含SiO2 、Fe2O3、Al2O3、Cu2(OH)2CO3的等杂质]和酸洗厂废酸液(含1mol/LH2SO4的FeSO4溶液)联合生产硫酸锰和铁红(Fe2O3)生产过程如下
Mn(OH)2 | Fe(OH)2 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | |
开始沉淀时 | 8.3 | 6.3 | 4.7 | 3.4 | 2.7 |
完全沉淀时 | 9.8 | 8.3 | 6.7 | 4.4 | 3.2 |
(1)含杂质的软锰矿使用前需将其粉碎,目的是______。
(2)滤渣1中含有的主要物质是_______。
(3)滤液1中,加氨水调控溶液pH至3.2,通入O2,反应的离子方程式是_______。若用H2O2代替O2,是否合理?理由是___________。
(4)软锰矿粉与硫酸和硫酸亚铁溶液反应的离子方程式是_________。
(5)滤液3中加入难溶电解质MnS的目的是(用离子方程式表示)_________。
(6)用重结晶法从滤液4中获取硫酸锰晶体的操作是:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种元素,他们性质如下:
A | 周期表中原子半径最小的元素 |
B | 电负性最大的元素 |
C | C的2p轨道中有三个未成对的单电子 |
D | 原子核外电子数是B与C核外电子数之和 |
E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答如下问题:
(1)基态E原子有_____个未成对电子,二价E离子的核外电子排布式为_______。
(2)A2D分子中D原子的杂化类型是______,D的氧化物DO3分子空间构型为_______。
(3)CA3极易溶于水,其原因主要是_____,试判断CA3溶于水后,形成CA3· H2O的合理结构:____ (填字母代号), 推理依据是_____。

(4)在ESO4溶液中滴入过量氨水,形成配合物的颜色为______,反应的离子方程式为_____。
(5)ZnD的晶胞结构如图1所示,在ZnD晶胞中,D2-的配位数为______。
(6)E与金形成的金属互化物结构如图2所示,其晶胞边长为a nm,该金属互化物的密度为______(用含a、NA的代数式表示)g· cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是( )
A.Al2O3熔点高,可用作耐高温材料
B.FeCl3溶液呈酸性,可用于腐蚀Cu
C.铝导热性好,可用铝罐贮运浓硝酸
D.浓硫酸具有强氧化性,可用于干燥CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极c、d表面镀一层细小的铂粉,吸附气体的能力强,性质稳定,请回答:
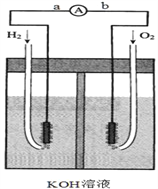
(1)氢氧燃料电池的能量转化主要形式是______。
(2)负极反应式为______.
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能,因此,大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
I.2Li+H2 = 2LiH II. LiH +H2O = LiOH + H2↑
①反应I中的还原剂是______,反应II中的氧化剂是______
②已知LiH固体密度为0.82g/cm3,用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为______。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为___________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com