
【题目】在AgNO3、Cu(NO3)2和Zn(NO3)2混合溶液中,加入一定量的铁粉,充分反应后过滤,在滤渣中加入稀盐酸,有气体产生。则下列结论正确的是
A. 滤液中一定有Fe(NO3)3
B. 滤渣只含Ag和Cu,一定无Zn
C. 滤渣中一定有Ag、Cu和Fe,一定无Zn
D. 滤渣中一定有Ag、Cu、Fe和Zn
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂与还原剂物质的量之比为1:2的是( )
A.3S+6NaOH═2Na2S+Na2SO3+3H2O
B.2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)2
C.I2+2NaClO3═2NaIO3+Cl2
D.4HCl(浓)+MnO2 ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.氯化铝溶液中加入过量氨水反应的实质是Al3++3NH3?H2O═Al(OH)3↓+3NH ![]()
B.存在于污水中的重金属离子,常用投加明矾等电解质的方法进行处理
C.镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液
D.依据铝热反应原理,能发生反应2Al+3MgO ![]() 3Mg+Al2O3
3Mg+Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3 , 向其中逐渐加入铁粉,溶液中Fe2+的浓度与加入铁粉的物质的量之间的关系如图所示.则溶液中Fe(NO3)3、Cu( NO3)2、HN03物质的量浓度之比为( ) 
A.1:1:1
B.1:3:1
C.2:1:4
D.1:1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p轨道有3个未成对电子;C的基态原子2p轨道有1个未成对电子;E原子最外层有1个未成对电子,其次外层有3种原子轨道且均排满电子,;D与E同周期,价电子数为2.则:
(1)写出基态E原子的电子排布式 .
(2)1mol A的单质分子中π键的个数为 .
(3)A、B、C 三种元素的氢化物稳定性由强到弱的顺序为(用化学式表示).
(4)A的简单氢化物分子的空间构型为 , 其中A原子的杂化类型是 .
(5)C和D形成的化合物的晶胞结构如图,已知晶胞边长a cm,阿伏加德罗常数为NA , 求晶体的密度为ρ=g/cm3 . (用含a、NA的计算式表示) 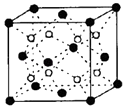
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)某容器中发生了一个化学反应,反应过程中存在H2O、ClO﹣、CN﹣、HCO3﹣、N2、Cl﹣六种粒子,在反应过程中测得ClO﹣和N2的物质的量随时间变化的曲线如图所示. 
该反应的离子方程式是 .
(2)氮氧化合物是大气污染的重要盐因素,将NOx转化为无害物质是当前研究的重要课题.
①下式中X必须为无污染的物质,系数n可以为0.
NO2+G ![]() N2+H2O+nX(未配平的反应式).
N2+H2O+nX(未配平的反应式).
下列化合物中,满足上述反应式中的G是(填写字母).
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
②若G为天然气的主要成分,则X为 , n= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3是一种常见的氧化剂,常用于医药工业、印染工业和制造烟火.实验室用KClO3和MnO2混合加热制氧气,现取KClO3和MnO2混合物16.60g加热至恒重,将反应后的固体加15g水充分溶解,剩余固体6.55g(25℃),再加5g水充分溶解,仍剩余固体4.80g(25℃).
(1)若剩余的4.80g固体全是MnO2 , 则原混合物中KClO3的质量为g;
(2)若剩余的4.80g固体是MnO2和KCl的混合物
(a)求25℃时KCl的溶解度;
(b)求原混合物中KClO3的质量;
(c)所得KCl溶液的密度为1.72g/cm3 , 则溶液的物质的量浓度为多少?(保留2位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com