
【题目】化学科学需要借助化学语言来描述,下列化学用语正确的是
A.NH4I的电子式: ![]()
B.Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
C.钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比不同
D.Al2O3的化学键类型与AlCl3的化学键类型相同
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图表示铁与不同浓度硝酸反应时,各种还原产物的相对含量与硝酸溶液浓度的关系,则下列说法不正确的是
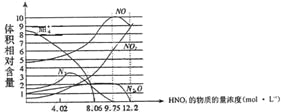
A. 一般来说,硝酸与铁反应的还原产物不是单一的
B. 用一定量的铁粉与大量的9.75mol·L—1HNO3溶液反应得到标态下气体2.24L,则参加反应的硝酸的物质的量为0.1mol.
C. 硝酸的浓度越大,其还原产物中价态越高的成份越多
D. 当硝酸浓度为9.75mol·L—1时还原产物是NO、NO2、N2O,且其物质的量之比为5:3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究物质的性质时,首先要分离提纯物质,对物质进行分离提纯是化学实验的重要内容。现需要纯净的氯化钠固体,但实验室中只有混有硫酸钠、碳酸氢铵的氯化钠固体。某同学设计了一个除去杂质获得纯净氯化钠溶液的实验方案:

(1)操作①中发生反应的化学方程式是 。(已知NH4HCO3受热后没有固体剩余,产生的气体中有一种能使红色石蕊试纸变蓝)
(2)操作②中BaCl2 溶液能否改用硝酸钡溶液 (填“能”或“不能”)。如果能,下一空不需要回答;如果不能,请说明理由: 。
(3)操作③的目的是 ;请你用实验方法确认操作③中碳酸钠已过量: 。
(4)操作④的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列4种重要的有机物:①CH3CH2CHO②![]() ③
③![]() ④
④![]() .
.
请回答:
(1)能与银氨溶液反应生成丙酸铵的是 (填序号).
(2)能与浓硝酸反应生成TNT的是 (填序号).
(3)能与甲醛在酸催化下相互缩合成高分子化合物的是 (填序号).
(4)写出②与NaOH的乙醇溶液共热生成丙烯的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某气态氧化物的化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL则该氧化物的摩尔质量为___________,R 的相对原子质量为_____________。
(2)已知CO、CO2的混合气体质量共15 g,标准状况下休积为8.8 L,则可推知该混合气体中含CO________g(保留两位有效数字)。
(3)同温同压下,SO2与氢气的密度之比为__________;若体积相同时,两种气体的质量比为___________。
(4)质量比为51∶32∶34的NH3、CH4、H2S,所含质子数之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于细胞内元素和化合物的叙述,正确的是
A. 组成细胞的主要元素中含量最多的是碳
B. 精瘦肉细胞中含量最多的化合物是蛋白质
C. 在人的一生中,细胞中的自由水/结合水的比值逐渐上升
D. 多糖、蛋白质、核酸等是以碳链为骨架的生物大分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5:有机化学基础】
盐酸普鲁卡因(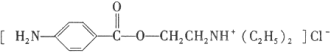 )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:

已知:①![]()
②![]()
③
请回答以下问题:
(1)A的核磁共振氢谱只有一个峰,则A的结构简式为 。
(2)C的结构简式为 ,C中含有的含氧官能团的名称为 。
(3)合成路线中属于氧化反应的有 (填序号),反应③的反应类型为 。
(4)反应⑤的化学反应方程式为 。
(5)B的某种同系物E,相对分子质量比B大14,其中—NO2与苯环直接相连,分子的核磁共振氢谱有3个峰,则E的结构简式为 (写一种)。
(6)符合下列条件的E的同分异构体的数目有 种。
① 结构中含有一个“—NH2”与一个“—COOH”
② 苯环上有三个各不相同的取代基
(7)苯丙氨酸(![]() )是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式 。
)是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.64 g SO2 含有氧原子数为NA
B.物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl- 数为NA
C.标准状况下,22.4 L H2O的分子数为NA
D.常温常压下,14 g N2含有分子数位0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性HSO3->I-,氧化性IO3->I2。在含3 mol NaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和析出的I2的物质的量的关系曲线如图(不考虑I2+I- ![]() I3-)下列说法不正确的是
I3-)下列说法不正确的是

A.a点时消耗NaHSO3的物质的量为1.2mol,得到的氧化产物为SO42-
B.b~c段的反应可用如下离子方程式表示:IO3-+5I-+6H+=3I2+3H2O
C.滴加过程中水的电离平衡一直逆向移动。
D.从c点后所得混合液中分离出碘的操作为:加四氯化碳萃取分液,然后蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com