
【题目】某次酸雨的分析数据如下:c (NH ![]() )=2×10﹣5mol/L、c(Cl﹣)=6×10﹣5mol/L、c (Na+)=1.9×10﹣5mol/L、c (NO
)=2×10﹣5mol/L、c(Cl﹣)=6×10﹣5mol/L、c (Na+)=1.9×10﹣5mol/L、c (NO ![]() )=2.3×10﹣5mol/L、c (SO
)=2.3×10﹣5mol/L、c (SO ![]() )=2.8×10﹣5mol/L,则此酸雨的pH约为( )
)=2.8×10﹣5mol/L,则此酸雨的pH约为( )
A.3
B.4
C.5
D.6
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在相应的条件下可能大量共存的是( )
A.能使pH试纸变红的溶液中:CO32﹣、K+、Cl﹣、Na+
B.![]() ═10﹣10mol/L的溶液中:Na+、HCO3﹣、Cl﹣、K+
═10﹣10mol/L的溶液中:Na+、HCO3﹣、Cl﹣、K+
C.在c(OH﹣)/c(H+)=1×1012的溶液中:NH4+、Fe2+、Cl﹣、NO3﹣
D.由水电离产生的c(OH﹣)=1×10﹣12mol/L的溶液中:NO3﹣、Mg2+、Na+、SO42
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据化学变化的实质是旧的化学键断裂、新的化学键形成这一理论,判断下列变化是化学变化的是
A.固体氯化钠溶于水B.二氧化氮溶于水
C.冰经加热变成水蒸气D.氯化氢溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定氢氧化钠的质量分数约为82%,为了验证其纯度,用浓度为0.1molL﹣1的盐酸进行滴定,完成下列问题: ①称取5.0g该氢氧化钠固体样品,配成500mL溶液备用;
②将标准盐酸装在酸式滴定管中,调节液面位置在“0”刻度以下,并记录下刻度;
③取25.00mL待测液.该项实验操作使用的主要仪器有(除锥形瓶外) , 用酚酞作指示剂时,滴定到溶液颜色由色刚好变成色为止;
④某同学根据三次实验分别记录有关数据如下表:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000molL﹣1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理数据列出氢氧化钠溶液物质的量浓度(计算结果保留4位有效数字):c(NaOH)= .
⑤由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是(填写编号)
A.中和滴定达终点时俯视滴定管内液面度数
B.碱式滴定管用蒸馏水洗净后立即取用25ml待测碱溶液注入锥形瓶进行滴定
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银耳本身为淡黄色,某地生产的一种“雪耳”,颜色洁白如雪.制作如下:将银耳堆放在密闭状态良好的塑料棚内,棚的一端支口小锅,锅内放有硫磺,加热使硫磺熔化并燃烧,两天左右,“雪耳”就制成了.“雪耳”炖而不烂,对人体有害,制作“雪耳”利用的是( )
A.硫的还原性
B.硫的漂白性
C.二氧化硫的还原性
D.二氧化硫的漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表各组物质之间通过一步反应不可以实现如下图所示转化关系的是

选项 | X | Y | Z | 箭头上所标数字的反应条件 |
A | SiO2 | Na2SiO3 | H2SiO3 | ①与Na2CO3熔融 |
B | NaCl | NaHCO3 | Na2CO3 | ②加热 |
C | N2 | NO2 | HNO3 | ③加热 |
D | C | CO | CO2 | ④灼热炭粉 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为98%的浓硫酸(ρ=l.84g·cm-3)配制240mLl.84mol.L-1稀硫酸,下列操作正确的是 ( )
A. 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,并不断搅拌至冷却
B. 必需的定量仪器有100mL量筒、250mL容量瓶和托盘天平
C. 先在容量瓶中加入适量水,将量好的浓硫酸注入容量瓶,加水定容
D. 量取浓硫酸的体积为25.0mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题.
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度. 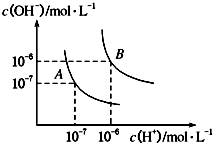
①100℃时1molL﹣1的NaOH溶液中,由水电离出的c(H+)=molL﹣1 , KW(25℃)KW(100℃)(填“>”、“<”或“=”).
②25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是(填“促进”、“抑制”或“不影响”).
(2)电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据.
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×10﹣7、K2=5.6×10﹣11 |
①25℃时,有等浓度的a.NaCN溶液 b.CH3COONa 溶液 c.Na2CO3溶液,三种溶液的pH由大到小的顺序为;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+)c(CH3COO﹣)(填“>”、“<”或“=”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.试回答下列问题: 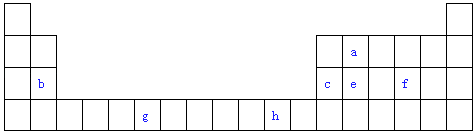
(1)写出元素g的基态原子电子排布式 .
(2)f在空气中燃烧产物的分子构型为 , 中心原子的杂化形式为 , 该分子是(选填“极性”、“非极性”)分子.
(3)由a原子跟e原子以1:1相互交替结合而形成的晶体,晶型与晶体e相同.两者相比熔点更高的是(填化学式),试从结构角度加以解释 .
(4)c单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示. 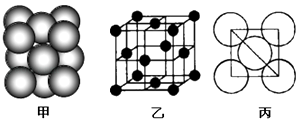
若已知c的原子半径为d厘米,NA代表阿伏伽德罗常数,c的相对原子质量为M,请回答:
①晶胞中c原子的配位数为 , 表示原子空间占有率的代数式为 .
②该晶体的密度为g/cm3(用含有关字母的代数式表示),b、h中,与c单质晶体中原子的堆积方式相同的是(填元素符号).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com