
【题目】根据![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五种元素的原子结构,回答下列问题:
五种元素的原子结构,回答下列问题:
(1)只有![]() 层与
层与![]() 层的原子有______;
层的原子有______;
(2)含有![]() 层的原子有______;
层的原子有______;
(3)最外层电子数相同的原子有______;
【答案】Be、N、Ne Na、Mg Be、Mg
【解析】
Be、N、Ne、Na、Mg的质子数分别为4、7、10、11、12,结合原子中质子数=核外电子数画出原子结构示意图;原子核外的电子是分层排布的,每一层都可以叫做能层,就是电子层;按电子的能量差异,可以将核外电子分成不同的能层,并用符号K、L、M、N、O、P、Q表示相应的第一、二、三、四、五、六、七能层,据此解答。
Be、N、Ne、Na、Mg的原子结构示意图分别为: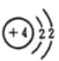 、
、 、
、 、
、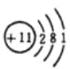 、
、 ;
;
(1)Be、N、Ne都只有两个能层,即K层和L层;
(2)Na、Mg有三个能层,即K层、L层和M层;
(3)Be、Mg的最外层电子数都为2,最外层电子数相同。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化合物如图的分子式均为C7H8。下列说法正确的是
![]()
A. W、M、N均能与溴水发生加成反应B. W、M、N的一氯代物数目相等
C. W、M、N分子中的碳原子均共面D. W、M、N均能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为1.0L的恒容密闭容器中发生反应:
CH3OH(g)+CO(g) ![]() CH3COOH(g)△H<0。下列说法正确的是
CH3COOH(g)△H<0。下列说法正确的是
容器编号 | 温度/K | 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | ||
c(CH3OH) | c(CO) | c(CH3COOH) | c(CH3COOH) | ||
I | 530 | 0.50 | 0.50 | 0 | 0.40 |
II | 530 | 0.20 | 0.20 | 0.40 | |
III | 510 | 0 | 0 | 0.50 | |
A. 达平衡时,容器I与容器II中的总压强之比为3:4
B. 达平衡时,容器II中![]() 比容器I中的大
比容器I中的大
C. 达平衡时,容器Ⅲ中的正反应速率比容器I中的大
D. 达平衡时,容器I中CH3OH转化率与容器III中CH3COOH转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛元素在周期表中的相对位置如图所示。甲和戊的原子序数相差3,戊的一种单质是自然界中硬度最大的物质,丁和辛属同周期元素。下列判断正确的是( )
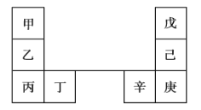
A.金属性:甲![]() 乙
乙![]() 丁
丁
B.原子半径:庚![]() 己
己![]() 戊
戊
C.丙和庚的原子核外电子数相差12
D.乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要视角.硫及其化合物与价态变化为坐标的二维转化关系如图1所示.
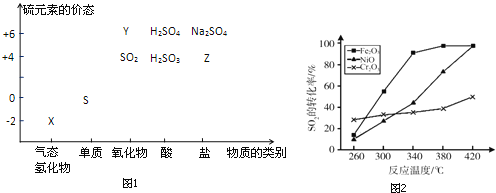
完成下列填空:
(1)图中X的电子式为__;其水溶液在空气中放置易变浑浊,写出反应的化学方程式__;该变化说明S的非金属性比O__(填“强”或“弱”),从原子结构的角度解释原因:__.通过__(举两例),也可以判断氧、硫两种元素的非金属性强弱.
(2)下列物质用于Na2S2O3制备,从氧化还原反应的角度,理论上有可能的是__(选填编号).
a Na2S+S b Z+S c Na2SO3+Y d NaHS+NaHSO3
(3)已知反应:Na2S2O3+H2SO4→Na2SO4+S↓+SO2+H2O,研究其反应速率时,下列方案合理的是__(选填编号).
a 测定一段时间内生成SO2的体积,得出该反应的速率
b 研究浓度、温度等因素对该反应速率的影响,比较反应出现浑浊的时间
c 用Na2S2O3固体分别与浓、稀硫酸反应,研究浓度对该反应速率的影响
(4)治理含CO、SO2的烟道气,以Fe2O3做催化剂,将CO、SO2在380℃时转化为S和一种无毒气体.已知:①硫的熔点:112.8℃、沸点:444.6℃;②反应每得到1mol硫,放出270kJ的热量.写出该治理烟道气反应的热化学方程式__.
(5)其他条件相同、催化剂不同时,上述反应中SO2的转化率随反应温度的变化如图2.不考虑催化剂价格因素,生产中选Fe2O3做催化剂的主要原因是__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.碳碳单键、碳碳双键、碳碳三键均能绕键轴旋转
B.烷烃分子中一个碳原子形成的四个键中每两个键的夹角均为109°28
C.甲烷、乙烯、乙炔分子中碳原子均为![]() 杂化
杂化
D.乙炔分子中碳碳三键与碳氢键的夹角为180°
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质只含![]() 、
、![]() 、
、![]() 三种元素,其分子模型如图所示,该分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。
三种元素,其分子模型如图所示,该分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。
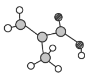
(1)该物质的结构简式为______。
(2)该物质中所含官能团的名称为______。
(3)下列选项中,与该物质互为同系物的是______(填序号,下同),互为同分异构体的是______。
①![]() ②
②![]()
③![]() ④
④![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是( )
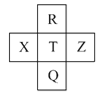
A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R<T<Q
D.最高价氧化物的水化物的酸性:R>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛在航天、潜海和医疗方面应用广泛。以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含少量Fe2O3]为原料制备钛的工艺流程如图所示。

(1)步骤②、③、④中,均需进行的操作是_____________(填操作名称)。
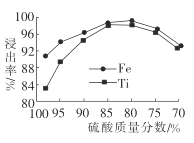
(2)滤液1中钛元素以TiO2+形式存在,步骤①中生成TiO2+的化学方程式为__________,硫酸质量分数对钛、铁浸出率的影响如图所示.据此判断,酸浸时所加硫酸的质量分数应为______(填范围)。.
(3)请结合离子方程式解释步骤④中加热水的原因:__________。
(4)电解法制备Ti的装置是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。Ti在_______(填“阳极”或“阴极”)生成,____(填“能”或“不能”)将熔融CaO换成石灰乳。
(5)以绿矾为原料,可以制备重要工业原料氧化铁,基本流程如下:
![]()
①绿矾溶液中离子浓度由大到小的顺序为__________。
②FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+ )=1.0×10-5 mol·L-1。所得FeCO3中_____(填“含”或“不含”)有Fe(OH)2。已知: {Ksp[Fe(OH)2]= 4.9×10-17}
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com