
【题目】已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。

回答下列问题:
(1)B、D分子中的官能团名称分别是______________、______________。
(2)写出下列反应的反应类型:①__________,②____________,④______________。
(3)写出下列反应的化学方程式:
②_______________________________________________________;
④________________________________________________________。
【答案】 羟基 羧基 加成 氧化 取代(酯化) 2 CH3CH2OH+O2![]() 2 CH3CHO + 2H2O CH3COOH + CH3CH2OH
2 CH3CHO + 2H2O CH3COOH + CH3CH2OH![]() CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O
【解析】A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,与水发生加成反应得到B为CH3CH2OH,乙醇和乙酸发生酯化反应生成乙酸乙酯,所以D为CH3COOH,乙醇被催化氧化生成乙醛,乙醛被氧化生成乙酸,所以C为CH3CHO;
(1)B为CH3CH2OH,含有的官能团为羟基,C为CH3CHO,含有的官能团为醛基;
(2)下列反应的反应类型分别为:①为加成反应,②为氧化反应,④为取代反应或酯化反应;
(3)②为乙醇的催化氧化反应,反应方程式为2 CH3CH2OH+O2![]() 2 CH3CHO+2H2O,
2 CH3CHO+2H2O,
④为乙醇与乙酸的酯化反应,反应方程式为CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O。
CH3COOCH2CH3+H2O。


 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于化学键的相关叙述正确的是
A. 共价键只存在于共价化合物和非金属单质中
B. 离子化合物中一定有离子键,也可能存在共价键
C. 化学键的断裂或形成一定伴随着化学反应的发生
D. 熔融状态或水溶液可导电的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断回答下列问题:
(1)f在周期表中的位置是__________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):____>____;比较g、h的最高价氧化物对应水化物的酸性强弱:____>____。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:________。
(4)写出e的单质在足量d2中燃烧反应的化学方程式:________________。
(5)上述元素可组成盐R:zx4f(gd4)2。向盛有10 mL 1 mol·L-1R溶液的烧杯中滴加1 mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下:

①写出m点反应的离子方程式:___________________。
②若在R溶液中改加20 mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol/L CH3COOH溶液中
逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中正确的是

A.a点表示溶液中c(CH3COO-)约为10-3 mol/L
B.b点表示的溶液中c(Na+)>c(CH3COO-)
C.c点表示CH3COOH和NaOH恰好反应完全
D.d点表示的溶液中![]() 大于K
大于K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、煤制天然气的工艺流程简图如下:

⑴反应I:C(s) + H2O(g)![]() CO(g) + H2(g) ΔH = +135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:___________________________。
CO(g) + H2(g) ΔH = +135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:___________________________。
⑵反应II:CO(g) + H2O(g) ![]() CO2(g) + H2(g) ΔH = 41 kJ·mol-1。如图表示不同温度条件下,煤气化反应I发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
CO2(g) + H2(g) ΔH = 41 kJ·mol-1。如图表示不同温度条件下,煤气化反应I发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。

① 判断T1、T2和T3的大小关系:______________。(从小到大的顺序)
② 若煤气化反应I发生后的汽气比为0.8,经煤气化反应I和水气变换反应II后,得到CO与H2的物质的量之比为1:3,则反应II应选择的温度是_______(填“T1”或“T2”或“T3”)。
⑶① 甲烷化反应IV发生之前需要进行脱酸反应III。煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和_______。
② 工业上常用热碳酸钾溶液脱除H2S气体得到两种酸式盐,该反应的离子方程式是_______。
II、利用甲烷超干重整CO2技术可得到富含CO的气体,将甲烷和二氧化碳转化为可利用的化学品,其能源和环境上的双重意义重大。该技术中的化学反应为:
CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g)
2H2O(g)+4CO(g) ![]() H>0
H>0
CH4超干重整CO2的催化转化原理示意如图:

⑷过程II,实现了含氢物种与含碳物种的分离。生成H2O(g)的化学方程式是______________。
⑸假设过程I和过程II中的各步均转化完全,下列说法正确的是_______。((填序号)
a.过程I和过程II中均含有氧化还原反应
b.过程II中使用的催化剂为Fe3O4 和CaCO3
c.若过程I投料![]() ,可导致过程II中催化剂失效
,可导致过程II中催化剂失效
(6)一定条件下,向体积为2L的恒容密闭容器中充入1.2 mol CH4(g)和4.8 mol CO2(g),发生反应CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g)
2H2O(g)+4CO(g) ![]() H>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,此反应的
H>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,此反应的![]() H=________________。
H=________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】位于前四周期的8种元素A、B、C、D、E、F、G、H的原子序数依次增大,其中A是所有原子中原子半径最小的,且与B同族,C的基态原子2P能级上只有1个电子,F可与A可按原子个数比1∶1和1∶2形成化合物;F与G同族,H的原子序数为29,根据上述信息描述,请回答下列问题:
(1)请写出上述8种元素中电负性最大的元素与B元素形成常见的化合物的化学式___(用具体元素符号表示的化学式),写出基态原子的第一电离能最大的元素在周期表中的位置为___。
(2)写出H的原子在基态时的核外电子排布式为_________。
(3)1mol D2A6分子(链状)中含有![]() 键的数目为________。
键的数目为________。
(4)已知A2F2分子结构如图a所示,则其中心原子杂化轨道类型为________。

(5)判断A2F2____(填难或易)溶于DG2,并简要说明原因_____________________。
(6)C与E形成某化合物的晶胞如图 b所示,则处于晶胞顶角上的原子的配位数为_______,若该化合物的密度为![]() g·cm-3,阿伏加德罗常数为NA,则两个最近E原子间的距离为____ pm(用含
g·cm-3,阿伏加德罗常数为NA,则两个最近E原子间的距离为____ pm(用含![]() 、NA的代数式表示)。
、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于铵盐的描述都正确的是
①都溶于水 ②都是白色晶体 ③都有刺激性气味 ④加热后都有氨气放出 ⑤与碱混合后加热都有氨气放出 ⑥都能使石蕊试纸变蓝
A. 全部B. ①②⑤⑥C. ①②⑤D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
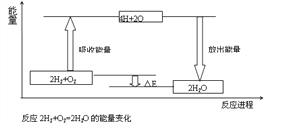
【题目】试从化学键的角度理解化学反应中的能量变化。(以2H2+O2===2H2O为例说明),已知:E反表示反应物(2H2+O2)所具有的总能量,E生表示生成物(2H2O)所具有的总能量。又知:拆开1moL H2中的化学键需要吸收436kJ能量,拆开1moL O2中的化学键需要吸收496kJ能量,形成水分子中的1moLH—O键能够释放463KJ能量。
⑴从宏观角度看:反应物所具有的总能量高于生成物所具有的总能量,所以该反应要______(填“吸收”或“放出”)能量,能量变化值的大小△E=_________(用E反和E生表示)
⑵从微观角度看:断裂反应物中的化学键吸收的总能量为E吸=______KJ;形成生成物中的化学键放出的总能量为=______KJ。E吸______E放(填“>”或“<”),所以该反应要_____(填“吸收”或“放出”)能量,能量变化值的大小△E=____ KJ(填数值)
⑶由图可知,化学反应的本质是________________________________化学反应中能量变化的主要原因是________________(从总能量说明)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com