
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |


科目:高中化学 来源: 题型:
| A、FeBr2中通入一定量Cl2:2Fe2++2Br-+2Cl2═4Cl-+Br2+2Fe3+ |
| B、少量SO2通入Ca(ClO)2溶液中:SO2+Ca2++2ClO-+H2O═CaSO3↓+2HClO |
| C、NaHCO3溶液中滴加NaOH溶液:HCO3-+OH-═H2O+CO2↑ |
| D、NaHSO4溶液中滴加Ba(OH)2溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH2=CH2 |
| B、CH≡CH |
| C、CH≡C-CH3 |
| D、CH2=C(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
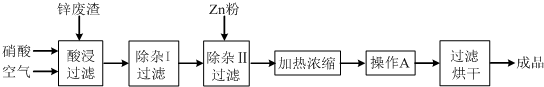
查看答案和解析>>
科目:高中化学 来源: 题型:
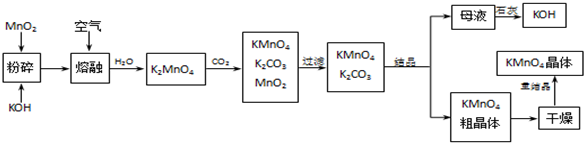
查看答案和解析>>
科目:高中化学 来源: 题型:
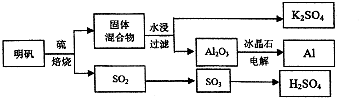
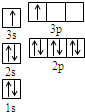 A、B、C、D、E都是周期表中前四周期的元素.已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大.B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区.C元素原子的外围电子层排布式为nsn-1npn-1. D原子M能层为全充满状态,且最外层无成对电子,E为第四周期未成对电子数最多的元素.请回答下列问题:
A、B、C、D、E都是周期表中前四周期的元素.已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大.B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区.C元素原子的外围电子层排布式为nsn-1npn-1. D原子M能层为全充满状态,且最外层无成对电子,E为第四周期未成对电子数最多的元素.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
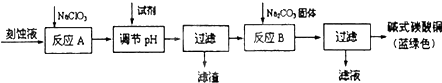
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
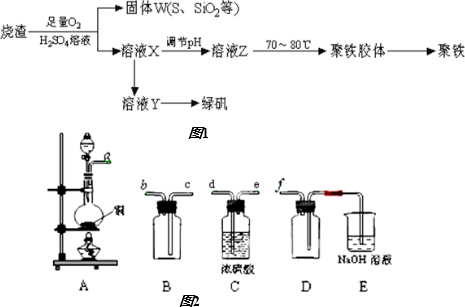
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com