
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。下列说法错误的是
B=11 | Al=27.4 | ?=68(甲) |
C=12 | Si=28 | ?=70(乙) |
N=14 | P=31 | As=75 |
O=16 | S=32 | Se=79.4 |
F=19 | Cl=35.5 | Br=80 |
A.元素甲位于现行元素周期表第四周期第ⅢA族
B.原子半径比较:甲![]() 乙
乙![]()
C.元素乙的简单气态氢化物的稳定性强于![]()
D.推测乙可以用作半导体材料
科目:高中化学 来源: 题型:
【题目】![]() 浓硝酸和
浓硝酸和![]() 铜反应,铜完全溶解,生成的气体颜色由深变浅
铜反应,铜完全溶解,生成的气体颜色由深变浅![]() 生成
生成![]() 、
、![]() ,共收集到
,共收集到![]() 气体
气体![]() 标准状况
标准状况![]() ,剩余酸用NaOH中和,共耗去
,剩余酸用NaOH中和,共耗去![]() 氢氧化钠
氢氧化钠![]() 。则浓
。则浓![]() 物质的量浓度为
物质的量浓度为![]()
![]()
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为:CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显色_________。
(2)能说明第①步反应达平衡状态的是___________。
A.Cr2O72-和CrO42-的浓度相同 B.2v(Cr2O72-)=v(CrO42-) C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要_________mol的FeSO47H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH)=1032,要c(Cr3+)降至105mol/L,溶液的pH应调至_________________。
Cr3+(aq)+3OH(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH)=1032,要c(Cr3+)降至105mol/L,溶液的pH应调至_________________。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为____________。
(6)在阴极附近溶液pH升高的原因是__________(用电极反应解释),溶液中同时生成的沉淀还有_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g)![]() H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1,
H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1,
①该反应在低温下___________(填“能”或“不能”)自发进行。
②写出该反应的平衡常数表达式_________________。
(2)已知在400℃时,N2(g)+3H2(g)![]() 2NH3(g)的K=0.5。
2NH3(g)的K=0.5。
①在400℃时,2NH3(g)![]() N2(g)+3H2(g)的K′=________(填数值)。
N2(g)+3H2(g)的K′=________(填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正________v(N2)逆(填“>”、“<”、“=”或“不能确定”)。
③若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡________移动(填“向左”、“向左”或“不”);反应的ΔH__________(填“增大”、“减小”或“不改变”)。
(3)水煤气转化反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)在一定温度下达到化学平衡。现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下两组教据:
CO2(g)+H2(g)在一定温度下达到化学平衡。现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下两组教据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 5 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
① 实验l中以CO2表示的反应速率为v(CO2)=____________;
② 实验1的平衡常数K1__________实验2的平衡常数K2(填“大于””小于,“等于”“不能确定”)。
③ 该反应正方向为_____________(填“吸”或‘放”)热反应;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香兰素是重要的香料之一,它可由丁香酚经多步反应合成。

有关上述两种化合物的说法正确的是
A. 常温下,1mol丁香酚只能与1molBr2反应
B. 丁香酚不能使FeCl3溶液发生显色反应
C. 1mol香兰素最多能与3mol氢气发生加成反应
D. 香兰素分子中至少有12个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是丁醇的两种同分异构体,其结构简式、沸点及熔点如下表所示:
异丁醇 | 叔丁醇 | |
结构简式 |
|
|
沸点/℃ | 108 | 82.3 |
熔点/℃ | -108 | 25.5 |
下列说法不正确的是
A. 用系统命名法给异丁醇命名为:2-甲基-1-丙醇
B. 异丁醇的核磁共振氢谱有三组峰,且面积之比是1∶2∶6
C. 用蒸馏的方法可将叔丁醇从二者的混合物中分离出来
D. 两种醇发生消去反应后得到同一种烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为1L的密闭容器中![]() 体积不变
体积不变![]() 充入
充入![]() 和
和![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如图所示。下列说法正确的是
的浓度随时间变化如图所示。下列说法正确的是
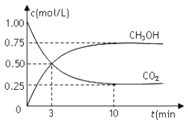
A.从反应开始到平衡,氢气的平均反应速率为![]()
B.进行到3min时,正反应速率和逆反应速率相等
C.10min后容器中各物质的量浓度不再改变
D.到达平衡状态时,反应放出![]() 的能量
的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Mg片和Al片为电极,并用导线连接,同时插入NaOH溶液中,下列说法正确的是
A.Mg片作负极,电极反应:Mg-2e- ![]() Mg2+
Mg2+
B.Al片作负极,电极反应:Al+4OH- -3e- ![]() AlO2- +2H2 O
AlO2- +2H2 O
C.电子从Mg电极沿导线流向Al电极
D.Al片上有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验淀粉水解的产物,设计如下实验方案:
![]()
请回答下列问题:
(1)试剂1为20%的H2SO4溶液,其作用是_________;
(2)试剂2为_________NaOH溶液,其作用是_________,使检验水解产物的实验得以顺利进行;发生反应的离子方程式为:_________;
(3)反应①的化学方程式为_________;
(4)为检验淀粉液是否已完全水解,取少量水解液于试管中,加入碘水,则证明淀粉未完全水解的现象是_________;
(5)如果实验过程中没有加入试剂2而直接加入试剂3,能否实现实验目的_________(填”能”或”否”)否,若不能,其原因是_________硫酸能溶解Cu(OH)2而使实验失败,最简单的改正措施是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com