
����Ŀ���±������ڱ��е�һ���֣����ݢ�--�������ڱ��е�λ�ã���Ԫ�ط�������ѧʽ�ش��������⣺
������ | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
1 | �� | |||||||
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� | �� |
��1������Ԫ�أ���ѧ��������õ���______����ԭ����ǿ�ĵ�����______���������ư뵼����ϵ�Ԫ����______��
��2���ڢڡ��ۡ��ܡ��ݡ��ޡ��ߡ��ࡢ���У�ԭ�Ӱ뾶������______��
��3���ȽϢޡ��ߡ�����⻯����ȶ�����������______��
��4����![]() λ��Ԫ�����ڱ��еڶ����ڵڢ�A�塣��ͬ�����£����������ᷴӦ�ȵ�������ᷴӦ����______��������������������������д���������ᷴӦ�Ļ�ѧ����ʽ__________��
λ��Ԫ�����ڱ��еڶ����ڵڢ�A�塣��ͬ�����£����������ᷴӦ�ȵ�������ᷴӦ����______��������������������������д���������ᷴӦ�Ļ�ѧ����ʽ__________��
���𰸡�Ne Na Si Na PH3 ���� ![]()
��������
���ݸ�Ԫ���ڱ��е�λ�ÿ�֪��Ԫ�طֱ�Ϊ����ΪH����ΪNa����ΪAl����ΪC����ΪSi����ΪP����ΪO����ΪF����ΪCl����ΪNe���ݴ˽��⡣
���ݸ�Ԫ���ڱ��е�λ�ÿ�֪��Ԫ�طֱ�Ϊ��ΪH����ΪNa����ΪAl����ΪC����ΪSi����ΪP����ΪO����ΪF����ΪCl����ΪNe��
��1������Ԫ�أ���ѧ��������õ���Ne����ԭ����ǿ�ĵ�����Na���������ư뵼����ϵ�Ԫ����Si��
����Ne�� Na��Si��
��2���ڢڡ��ۡ��ܡ��ݡ��ޡ��ߡ��ࡢ���У�ԭ�Ӱ뾶������Na��
�ʴ�Ϊ��Na��
��3���ޡ��ߡ�����⻯��ֱ�Ϊ��PH3��H2O��HCl�����ȶ�����������PH3��
����PH3��
��4��ͬ���ڴ������ҽ����Լ�������ͬ�����£����������ᷴӦ�ȵ�������ᷴӦ���ӻ������������ᷴӦ�Ļ�ѧ����ʽΪBe+2HCl=BeCl2+H2����
����������Be+2HCl=BeCl2+H2����


 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L�ܱ������ڣ�800��ʱ��Ӧ2NO(g)+O2(g)��2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)������Ӧ_____(������������������)���淴Ӧ��
(2)��ͼ��ʾ����ʾNO2�仯���ߵ���____����O2��ʾ0��1s�ڸ÷�Ӧ��ƽ������v=____��

(3)��˵���÷�Ӧ�Ѵﵽƽ��״̬����____(����ĸ)��
a��v(NO2)=2v(O2) b��������ѹǿ���ֲ���
c��v��(NO)=2v��(O2) d���������ܶȱ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CH4��������CO2�����ɵõ�����CO�Ļ���ԭ�ϡ��ش��������⣺
��1��CH4��������CO2�Ĵ�ת����ͼ��ʾ��
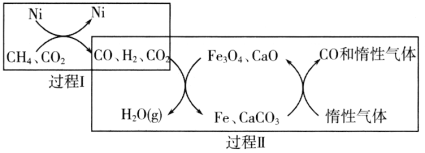
����֪��ط�Ӧ�������仯��ͼ��ʾ��

���̢���Ȼ�ѧ����ʽΪ________��
�ڹ����������̢��˵������ȷ����________������ţ���
a��ʵ���˺�̼�����뺬�����ʵķ���
b���ɱ�ʾΪCO2��H2��H2O��g����CO
c��COδ���뷴Ӧ
d��Fe3O4��CaOΪ�����������˷�Ӧ�Ħ�H
�������������䣬�ڲ�ͬ�������������£���ӦCH4��g����CO2��g����2CO��g����2H2��g��������ͬʱ���CH4��ת�����淴Ӧ�¶ȵı仯��ͼ��ʾ��a����������״̬________����ǡ����ǡ���ƽ��״̬��b��CH4��ת���ʸ���c�㣬ԭ����________��
��2����һ�����ܱ������У�CH4��CO2�ķ�ѹ�ֱ�Ϊ20kPa��25kPa������Ni������Al2O3������������1123Kʹ�䷢����ӦCH4��g����CO2��g����2CO��g����2H2��g����

���о�����CO���������ʦԣ�CO����1.3��10��2��p��CH4����p��CO2��mol��g��1��s��1��ijʱ�̲��p��CO����20kPa����p��CO2����________kPa���ԣ�CO����________mol��g��1��s��1��
�ڴﵽƽ�������ϵѹǿ����ʼʱ��1.8������÷�Ӧ��ƽ�ⳣ���ļ���ʽΪKp��________��kPa��2�����ø����ʵķ�ѹ�������ʵ���Ũ�ȼ��㣩
��3��CH4��������CO2�õ���CO��ż����Ӧ���Ƶò��ᣨH2C2O4���������£���ijŨ�ȵIJ�����Һ�м���һ��Ũ�ȵ�NaOH��Һ��������Һ��![]() �����ʱ��Һ��pH��________������֪������H2C2O4��Ka1��6��10��2��Ka2��6��10��5��lg6��0.8��
�����ʱ��Һ��pH��________������֪������H2C2O4��Ka1��6��10��2��Ka2��6��10��5��lg6��0.8��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ���ʺ���������������������ء�
(1)ijѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯���� 400mL ϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų���������ʵ���¼����(�ۼ�ֵ)��
ʱ��/min | 1 | 2 | 3 | 4 | 5 |
�������/mL (��״��) | 100 | 240 | 464 | 576 | 620 |
����һʱ��η�Ӧ�������______min(����0��1����1��2����2��3����3��4������4��5��)��ԭ����______��
���� 3��4 min ʱ����������Ũ�ȱ仯����ʾ�ĸ÷�Ӧ����______(����Һ�������)��
(2)��һѧ��Ϊ���Ʒ�Ӧ���ʷ�ֹ��Ӧ�������Բ�������������������������м���������������Һ�Լ�����Ӧ���ʣ�����Ϊ�����е���______ (����ĸ)��
A.����ˮ B.KCl ��Һ C.KNO3 ��Һ D.CuSO4 ��Һ
(3)ij�¶����� 4 L �ܱ������У�X��Y��Z ������̬���ʵ����ʵ�����ʱ��仯������ͼ��

���÷�Ӧ�Ļ�ѧ����ʽ��______��
���÷�Ӧ�ﵽƽ��״̬�ı�־��_______(����ĸ)��
A.Y ����������ڻ�������б��ֲ���
B.X��Y �ķ�Ӧ���ʱ�Ϊ 3:1
C.����������ѹǿ���ֲ���
D.��������������������ֲ���
E.���� 1mol Y ��ͬʱ���� 2mol Z
��2 min �� Y ��ת����Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2017��12�·���ίӡ����![]() ȫ��̼�ŷ�Ȩ�����г����跽����������ҵ�����������ƶ���������ɫ��̼ת���������� ��������֮��Υ������
ȫ��̼�ŷ�Ȩ�����г����跽����������ҵ�����������ƶ���������ɫ��̼ת���������� ��������֮��Υ������
A.�ƹ�ʹ�ù�����ͨ���߳���B.�ᳫֲ�����֣��̻�����
C.���ٶ�����̼���ŷ�D.�����ƹ�ȼú��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���Ȼ���ˮ������ӷ���ʽΪ_________________________________�������Ȼ�����Һ�����ɲ����յõ�_______(�ѧʽ)��
��2��25��ʱ��NH4Cl��Һ��_________�ԣ�ԭ���ǣ������ӷ���ʽ��ʾ��__________�������������İ�ˮ��ʹ��Һ��c��NH4+��=c��Cl����������Һ��pH___7�����������������=����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɫ������ָ���������̼���Ͻ����������������Ź㷺����;����ش��������⣺
(l)��̬��ԭ�Ӻ������___ �������෴�ĵ��ӣ���δ�ɶԵ�����____�ֿռ���չ���������̵ĵ���������(I3)�ϴ����____����Ԫ�ط��ţ���ԭ����____��
(2)�����ϩ![]() ����ɫҺ�壬�۵�-97.5�棬�е�40. 0�棬������ú�����С�
����ɫҺ�壬�۵�-97.5�棬�е�40. 0�棬������ú�����С�
�ٻ����ϩ�����д��ڵ������������____
A ���»��� B ��� C ���� D ����
�ڻ����ϩ������̼ԭ�ӵ��ӻ����������_____
��������������ṩ���ӶԵķ�ʽ�����¶Ե��ӡ��е��ӵȡ���ï���ķ��ӽṹ��ͼ��ʾ������������λ����____��

(3)�����̵�һ���������������ṹʾ��ͼ��ͼ��ʾ����֪��ԭ�Ӱ뾶Ϊ141. 4pm����þ�������a= ___�����ھ���ȱ����ɾ���ṹ�в���ԭ��ȱʧ�����ʵ���ܶ�Ϊ5. 52g��cm-3��MnԪ�����ԭ��������Ϊ54. 94���㣬�˾�����ȱ����Ϊ____��ȱ����Ϊ��λ�����ȱʧԭ����ռӦ��ԭ�������İٷֱȣ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס�����Ԫ�������ڱ��е����λ�����±����������ԭ���������3�����һ�ֵ�������Ȼ��Ӳ���������ʣ���������ͬ����Ԫ�ء������ж���ȷ����(����)

A.�����ԣ���>��>��
B.ԭ�Ӱ뾶����>��>��
C.�������ԭ�Ӻ�����������13
D.�ҵĵ����ڿ�����ȼ������ֻ�����Ӽ��Ļ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС���ͬѧ������ͼ��ʾʵ��װ�ý���ʵ�飨ͼ��a��b��c��ʾֹˮ�У���

�밴Ҫ����գ�
��1��Aװ���м���������Ϊ______��
��2��A��C��E�������װ�ÿ�������ȡCl2��������ص�����ʵ�顣
�� A����ΪMnO2���壬����ʢ��Ũ���ᣬ����ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ_____________��
�� ���ڱ��м�������ˮ�������Ƶ���ˮ����������ˮ�ֳ����ݣ����Т�����ʵ�飬ʵ�����������������£�
��. ����ˮ����Ʒ����Һ�У�����________________��
��. ��ˮ�м��� NaHCO3��ĩ������ɫ���ݲ�����ijͬѧ�ó����ۣ�������ˮ��Ӧ�IJ�����н�ǿ�����ԡ��������۸�ͬѧ�Ľ����Ƿ������������������˵�����ɡ� ___________________
��Eװ�õ�����__________________��
��3��B��D��Eװ����������B��ʢװŨ�����ͭƬ�������п����ϰ��ϣ����ر�ֹˮ��c���Ƶ�NO2�������ٽ����й�ʵ�顣
�� ����Dװ����֤NO2��ˮ�ķ�Ӧ�����������Ϊ���ȹر�ֹˮ��_____���ٴ�ֹˮ��_____��ʹ�ձ��е�ˮ�����Թܶ��IJ�����_________________��
�� NO2β������NaOH��Һ���������������Σ�д����Ӧ�Ļ�ѧ����ʽΪ____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com