
【题目】铁及其化合物在生产生活中有着广泛的应用。回答下列问题:
(1)基态Fe原子的外围电子排布图为____,基态Fe2+中,核外电子占据最高能层的符号是____,Fe2+和Fe3+是铁的两种常见离子,Fe3+的稳定性强于Fe2+,原因是____。
(2)Fe3+可以与SCN—形成一系列不同配位数的红色配合物,所以常用KSCN溶液检验Fe3+的存在,KSCN中四种元素的电负性由小到大的顺序为_______,SCN—的几何构型为______,中心原子的杂化类型为_______。
(3)实验中常用K3[Fe(CN)6]检验Fe2+, K3[Fe(CN)6]晶体中的化学键有_________(填写选项字母)
a.离子键. b.共价键 c,氢键 d .配位键 e.金属键
1mol K3[Fe(CN)6]中含有σ键与π键的数目比为_____________。
(4)FexO为氯化钠型结构,在实际晶体中,由于存在缺陷,x<1。 测得Fe0.92O晶体的晶胞参数a=428.0pm,则该晶体的密度ρ=__________g/cm3 (列出计算式),晶体中最近的两个铁离子间的距离为_______pm。
【答案】![]() M Fe3+的价电子排布为3d5,半满结构稳定 K<C<S<N 直线形 sp a、b、d 1:1
M Fe3+的价电子排布为3d5,半满结构稳定 K<C<S<N 直线形 sp a、b、d 1:1 ![]() 302.6
302.6
【解析】
(1)依据铁的原子序数,推测其核外电子排布式,然后书写其外围电子轨道式,外围电子轨道式也是价电子轨道式;
(2)结合元素的非金属的强弱,同周期元素非金属性性质的递变规律,确定元素C、N、S、K非金属性的强弱;利用SCN—与二氧化碳等电子体,推测SCN—的几何构型,以及中心原子C的杂化类型;
(3)依据离子键、共价键、金属键的定义判断 K3[Fe(CN)6]晶体中含有的哪些类型的化学键;
(4)根据氯化钠晶胞结构的特征,去计算Fe0.92O晶体的密度。
(1)Fe的原子序数为26,基态Fe原子的外围电子排布式为3d64s2,基态Fe原子的外围电子排布图为![]() ;基态Fe2+的核外电子排布式为[Ar]3d6,核外电子占据最高能层的符号是M;Fe3+的稳定性强于Fe2+,原因是Fe3+的价电子排布为3d5,半满结构稳定;
;基态Fe2+的核外电子排布式为[Ar]3d6,核外电子占据最高能层的符号是M;Fe3+的稳定性强于Fe2+,原因是Fe3+的价电子排布为3d5,半满结构稳定;
(2)液态NH3和液态H2S相比,液态NH3分子间存在氢键,说明N比S更强烈的吸引H上的电子,而形成氢键,所以就电负性而言,NS,C与N同一周期,电负性NC,硫酸是强酸,而碳酸是弱酸,故电负性SC,K是金属元素,K的电负性最小,所以KSCN中四种元素的电负性由小到大的顺序为K<C<S<N;SCN—与二氧化碳等电子体,几何构型为直线形,中心原子的杂化类型为sp;
(3)a.K+与[Fe(CN)6]3-形成离子键,a正确;
b.[Fe(CN)6]3-离子中,C原子与N原子之间形成极性共价键,b正确;
c.氢键不属于化学键,c错误;
d.Fe3+与CN-形成配位键,d正确;
e.K3[Fe(CN)6]不属于金属晶体,不存在金属键,e错误;
答案选a、b、d;
在配合物K3[Fe(CN)6]中,Fe3+与CN-之间形成6个配位键,配位键也是σ键,在每个CN-内部有1个σ键和2个π键,故1mol K3[Fe(CN)6]中含有σ键的数目为12NA,π键的数目为12NA,故1mol K3[Fe(CN)6]中含有σ键与π键的数目比为1:1;
(4)FexO为氯化钠型结构,每个晶胞中含有4个“FexO”,测得Fe0.92O晶体的晶胞参数a=428.0pm,所以(428.0×10-10)3×ρ×6.02×1023=4×(56×0.92+16),ρ=![]() g/cm3 ;由氯化钠的晶胞图形,设Fe在面心,另外的Fe在立方体的顶点,面对角线的一半为晶体中最近的两个铁离子间的距离,其距离为
g/cm3 ;由氯化钠的晶胞图形,设Fe在面心,另外的Fe在立方体的顶点,面对角线的一半为晶体中最近的两个铁离子间的距离,其距离为![]() =302.6pm。
=302.6pm。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在容积固定的密闭容器中存在如下反应:N2(g)+3H2![]() 2NH3(g) △H<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出如下关系图,分析正确的是
2NH3(g) △H<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出如下关系图,分析正确的是
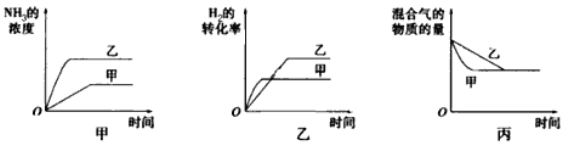
A. 图甲研究的是温度对反应的影响,且甲的温度比乙高
B. 图乙研究的是压强对反应的影响,且甲的压强比乙大
C. 图乙研究的是温度对反应的影响,且甲的温度比乙高
D. 图丙研究的是不同催化剂对反应的影响,且乙使用的催化剂效率比甲高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-=NO↑+2H2O,KMnO4、Na2CO3、Cu2O、FeSO4四种物质中有物质(甲)能使上述还原过程发生。则下列说法中正确的是
A. 在上述反应中,电子从氧化剂转移到还原剂
B. 物质甲可能是KMnO4
C. 反应中若产生3.0g气体,则转移电子数约为0.3×6.02×1023
D. 氧化过程的反应式一定为Cu2O-2e-+2H+=2Cu2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述不正确的是
A.乙烯和环丁烷(C4H8)的混合气体共28g含有的原子数目为6NA
B.0.1 mol羟基中所含有的电子数为NA
C.1 L0.1 mol·L-1 Na2S溶液中,S2-、 HS-和H2S的微粒数之和为0.1NA
D.在K37C1O3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若反应中电子转移的数目为10NA则有424g氯气生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10L密闭容器中加入5.0molSO2、4.5molO2,经10min后反应达到平衡,此时容器中气体的平均分子量为58。请计算(写出计算过程):
(1)10min内SO2的转化率;
(2)容器内反应前与平衡时的压强之比(最简整数比) ;
(3)该温度下的平衡常数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素![]() 、
、![]() 、
、![]() 、
、![]() 的原子序数依次增大,
的原子序数依次增大,![]() 的最高正价与最低负价代数和为0,
的最高正价与最低负价代数和为0,![]() 、
、![]() 、
、![]() 形成的化合物甲的结构如图所示,
形成的化合物甲的结构如图所示,![]() 在同周期中原子半径最小。下列说法正确的是( )
在同周期中原子半径最小。下列说法正确的是( )
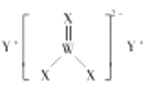
A.原子半径大小:![]()
B.电负性大小:![]()
C.![]() 、
、![]() 形成的化合物为离子化合物
形成的化合物为离子化合物
D.化合物甲中阴离子的空间构型为三角锥形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜铁是目前人们使用量最大的合金材料,铁及其化合物也是人们日常生活中应用广泛的一类物质。回答下列问题:
(1)下图中铁钉发生的电化学腐蚀类型是________,负极反应式为__________。
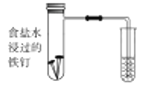
(2)实验室配置![]() 溶液时,需向溶液中滴加几滴稀硫酸,其目的是__________,
溶液时,需向溶液中滴加几滴稀硫酸,其目的是__________,![]() 溶液中离子浓度由大到小的顺序是________。
溶液中离子浓度由大到小的顺序是________。
(3)高铁盐酸是一种新型的环境消毒剂及水体净化剂,如高铁酸钾(![]() )。其中
)。其中![]() 的化合价是________,其净水过程中既表现出强氧化性,又表现了强吸附性,则
的化合价是________,其净水过程中既表现出强氧化性,又表现了强吸附性,则![]() 与水反应的离子方程式为__________。
与水反应的离子方程式为__________。
(4)羰基铁酸[![]() ]是一种二元弱酸,其第一步电离方程式为__________。
]是一种二元弱酸,其第一步电离方程式为__________。
(5)25℃时,向含![]() 的溶液中加入一定量的
的溶液中加入一定量的![]() 后,
后,![]() 恰好达到溶液平衡,测得溶液的
恰好达到溶液平衡,测得溶液的![]() ,
,![]() 。通过计算判断所得的
。通过计算判断所得的![]() 中是否含有
中是否含有![]() 杂质:________(已知:
杂质:________(已知:![]() ,
,![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学化学课外兴趣小组通过实验探究Fe2+、Fe3+的性质。回答下列问题:
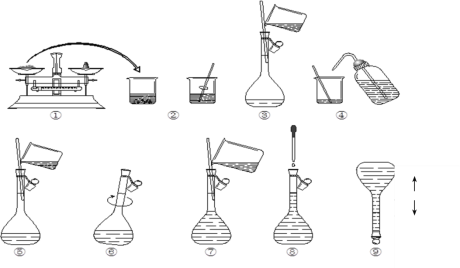
(1)本次实验中共需要1mol/LFeCl2溶液100 mL,配制时涉及到如下操作:
①步骤③中玻璃棒的作用是__;
②在配制溶液过程中步骤⑦所进行的操作是___(填“洗涤”、“转移”、“定容”);该步中视线应与溶液凹液面的最低处保持___。
③下列操作会使所配溶液物质的量浓度偏低的是___。
A.溶解后小烧杯、玻璃棒没有洗涤
B.所用容量瓶中,已有少量蒸馏水
C.定容、加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度线
(2)取2mLFeCl2溶液于试管中,加入几滴氯水,再加入1滴KSCN溶液,观察到的现象为__,说明Cl2可将Fe2+氧化成Fe3+。FeCl2溶液与氯水反应的离子方程式为___,此时将所取FeCl2溶液完全反应需__molCl2。
(3)在(2)溶液中加入过量的铁粉,溶液变成___色;发生反应的离子方程式为__,此时溶液中所含铁元素的微粒的物质的量为__mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com