
����Ŀ������A��B��C��D��E��F���ֶ���������Ԫ�أ�ԭ����������������֪A����̬�⻯������������������ˮ���ﷴӦ��Bԭ�������������ǵ��Ӳ�����3����C+��D3+���ӵĵ��Ӳ�ṹ��ͬ��B��E����ͬһ���壮
��ش��������⣺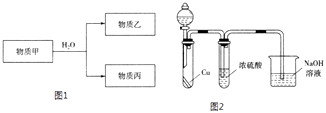
��1��E��Ԫ�����ڱ��е�λ����
��2������Ԫ���γɵļ������У��뾶��С�����������ӷ��ţ���
��3��������Ԫ���е�һ�ֻ�����ɵ����ʼ��Է�����ͼ1��Ӧ��
�����Ҿ���Ư���ԣ����ҵĵ���ʽΪ ��
��������ˮ��Һ��ǿ������Һ�����Ϊ�����ѧʽ����
������Ϊ��Ԫ���ᣬ����������ǿ�ᡢ��������ǿ����ҵ�����Ϊ���õ��뷽��ʽ��ʾ����������ǿ�ᡢ��������ǿ���ԭ�� ��
������������Ϊ����ɫ����ͬѧ��Ϊ��Ũ������Ը�������ס���Ϊ��֤��۵��Ƿ���ȷ������ͼ2װ�ý���ʵ��ʱ����Һ©����Ӧ���������Լ����ƣ���ʵ������У�Ũ������δ�����������ݳ�������Һ��Ϊ����ɫ���ɴ˵ó��Ľ����� ��
���𰸡�
��1���������ڵ�VIA��
��2��Al 3+
��3��![]() ��Na��Na2O2������������AlO2��+H2O+H+?Al��OH��3?Al3++3OH����Ũ���Ũ����ܸ�������������������������Ũ����
��Na��Na2O2������������AlO2��+H2O+H+?Al��OH��3?Al3++3OH����Ũ���Ũ����ܸ�������������������������Ũ����
���������⣺A��B��C��D��E��F���ֶ���������Ԫ�أ�ԭ��������������A����̬�⻯������������������ˮ���ﷴӦ����A��NԪ�أ�
Bԭ�������������ǵ��Ӳ�����3����BΪOԪ�أ�
B��E����ͬһ���壬��E��SԪ�أ�FΪ����������Ԫ����ԭ����������E����FΪClԪ�أ�
C+��D3+���ӵĵ��Ӳ�ṹ��ͬ��Ϊ��������Ԫ�أ�C��D�ֱ�ΪNa��AlԪ�أ���1��E��SԪ�أ�Sԭ�Ӻ�����Ӳ�����������������������������������������Sԭ�Ӻ�����3�����Ӳ㡢������������6������Sλ�ڵ������ڵ�VIA�壬���Դ��ǣ��������ڵ�VIA�壻��2������Ԫ���γɵļ������У����Ӳ���Խ�ٵ�ԭ�Ӱ뾶ԽС�����Ӳ�ṹ��ͬ�����ӣ����Ӱ뾶����ԭ�������������С���⼸��Ԫ���γɵ����Ӱ뾶��С˳����S 2����Cl����N3����O 2����Na+��Al 3+ �� �������Ӱ뾶��С����Al 3+ �� ���Դ��ǣ�Al 3+����3�������Ҿ���Ư���ԣ�ΪHClO�����������������HCl��HClO������Oԭ�Ӻ�H��Clԭ��֮��ֱ���һ�Ե��ӣ�����ʽΪ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����������ˮ��Һ��ǿ������Һ�����ΪNa��Na2O2 �� ��ΪNaOH����Ϊ���������������Դ��ǣ�Na��Na2O2��������Ϊ��Ԫ���ᣬ����������ǿ�ᡢ��������ǿ���Ϊ������������Ϊ���⣬�����������������Ϊ����������ᣬ���������ܷ�����ʽ����Ҳ�ܷ�����ʽ���룬���뷽��ʽΪAlO2��+H2O+H+Al��OH��3Al3++3OH�� �� ������������������ǿ���ǿ����Һ�����Դ��ǣ�����������AlO2��+H2O+H+Al��OH��3Al3++3OH����������������Ϊ����ɫ������ΪNO����Ϊ������������ͬѧ��Ϊ��Ũ������Ը�������ס���Ϊ��֤��۵��Ƿ���ȷ������ͼ2װ�ý���ʵ��ʱ��Ũ�����Cu��Ӧ���ɶ������������Է�Һ©����Һ����Ũ���ᣬʵ������У�Ũ������δ�����������ݳ�������Һ��Ϊ����ɫ���������������Ũ���ᣬ˵����������������Ũ�����Ũ����ܸ������������
����������ˮ��Һ��ǿ������Һ�����ΪNa��Na2O2 �� ��ΪNaOH����Ϊ���������������Դ��ǣ�Na��Na2O2��������Ϊ��Ԫ���ᣬ����������ǿ�ᡢ��������ǿ���Ϊ������������Ϊ���⣬�����������������Ϊ����������ᣬ���������ܷ�����ʽ����Ҳ�ܷ�����ʽ���룬���뷽��ʽΪAlO2��+H2O+H+Al��OH��3Al3++3OH�� �� ������������������ǿ���ǿ����Һ�����Դ��ǣ�����������AlO2��+H2O+H+Al��OH��3Al3++3OH����������������Ϊ����ɫ������ΪNO����Ϊ������������ͬѧ��Ϊ��Ũ������Ը�������ס���Ϊ��֤��۵��Ƿ���ȷ������ͼ2װ�ý���ʵ��ʱ��Ũ�����Cu��Ӧ���ɶ������������Է�Һ©����Һ����Ũ���ᣬʵ������У�Ũ������δ�����������ݳ�������Һ��Ϊ����ɫ���������������Ũ���ᣬ˵����������������Ũ�����Ũ����ܸ������������
���Դ��ǣ�Ũ���Ũ����ܸ�������������������������Ũ���ᣮ



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���£���11.2L CO2����ͨ��300mL 2molL��1��NaOH��Һ�У�����ַ�Ӧ��������Һ���ɲ�������գ�������ù�����������Ϊ�� ��
A.31.8g
B.53g
C.63.6g
D.84g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ԭ�ӹ������������ȷ����
A. ��ԭ�ӵ�2s���������3p�����
B. �ܲ�n��4��ԭ�ӹ����������16������
C. �ԭ�ӵ�2s��5s �����Ϊ����
D. p�ܼ���ԭ�ӹ���������Σ������ܲ����������ӣ�p�ܼ�ԭ�ӹ��Ҳ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��K2Cr2O7��Һ�д���ƽ�⣺Cr2O72-����ɫ��+H2O![]() 2CrO42-����ɫ��+2H+����K2Cr2O7��Һ��������ʵ�飺���ʵ�飬����˵������ȷ����
2CrO42-����ɫ��+2H+����K2Cr2O7��Һ��������ʵ�飺���ʵ�飬����˵������ȷ����

A. ������Һ��ɫ���������Һ���
B. ����Cr2O72-��C2H5OH��ԭ
C. �ԱȢںܿ͢�֪K2Cr2O7������Һ������ǿ
D. ������м���70%H2SO4��Һ����������Һ��Ϊ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ȤС���ijƷ��������Ħ�����ɷּ��京����������̽���� ������ϣ�������Ħ������̼��ơ�����������ɣ������������ɷ���������ʱ���������ɣ�
��1��Ħ���������������Ķ��Լ��� ȡ����������Ʒ����ˮ�ɷֽ��衢���ˣ�
���������м������NaOH��Һ�����ˣ�����������NaOH��Һ��Ӧ�����ӷ���ʽ��
������������Һ����ͨ�����������̼���ټ������ϡ���ᣮ�۲쵽�������ǣ�
��2��������Ʒ��̼��ƵĶ����ⶨ ������ͼ��ʾװ�ã�ͼ�мг�������ȥ������ʵ�飬��ַ�Ӧ�ⶨC�����ɵ�BaCO3������������ȷ��̼��Ƶ�����������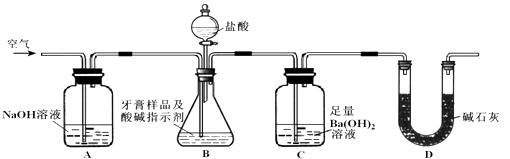
����ʵ����̻ش��������⣺
��ʵ����������������ͨ������������ó��˿ɽ���B��C�еķ�Ӧ���⣬���У�
��C�з�Ӧ����BaCO3�����ӷ���ʽ��
�����и����ʩ�У�������߲ⶨȷ�ȵ��������ţ�
a���ڼ�������֮ǰ��Ӧ�ž�װ���ڵ�CO2����
b���μ�����˹���
c����A��B֮������ʢ��Ũ�����ϴ��װ��
d����B��C֮������ʢ�б���̼��������Һ��ϴ��װ��
��ʵ����ȷ��ȡ8.00g��Ʒ���ݣ��������βⶨ�����BaCO3ƽ������Ϊ3.94g������Ʒ��̼��Ƶ���������Ϊ��BaCO3��Ħ������Ϊ197g/mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��֤��ij��Һֻ����Fe2+��������Fe3+��ʵ�鷽����
A���ȵμ���ˮ���ٵμ�KSCN��Һ���Ժ�ɫ
B���ȵμ�KSCN��Һ�����Ժ�ɫ���ٵμ���ˮ���Ժ�ɫ
C���μ�NaOH��Һ��������ɫ����
D��ֻ��μ�KSCN��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��������������ƣ����й�������ƶ��У���ȷ���ǣ� ��
A.�����������ڱ��д���ͬһ����
B.���������������ˮ
C.������ȿ�����ǿ�ᷴӦ���ֿ�����ǿ�Ӧ
D.�Ȼ���Ļ�ѧʽΪBeCl3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ڽ��ˮ����
A.������������֭B.�����ڼ����IJ�֭
C.������������ˮD.���ջ������ɹ��������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش��������⣺
��1��д���������ʵĵ��뷽��ʽ��
Ba��OH��2��
Fe2��SO4��3��
H2SO4 ��
��2�����NaHSO4�ĵ��뷽��ʽ����д�ɣ�NaHSO4=Na++H++SO42�� �� ��ô����NaHSO4��Һ������������Һ��ȫ��Ӧ�����ӷ���ʽ�ǣ� ��
��3���á�˫���š������Է�ӦMnO2+4HCl=MnCl2+Cl2+2H2O���л��ϼ۱仯������ת���Լ���������ԭ������ �� ������������ �� ��ԭ���� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com