
����Ŀ��ά����C��һ��ˮ����ά����(��ˮ��Һ������)�����Ļ�ѧʽ��C6H8O6������ȱ��������ά�����ܵû�Ѫ֢������ά����C�ֳƿ���Ѫ�ᡣ�����ʵ�ˮ�����߲ˡ�����Ʒ�ж�����ά����C���������ʳ�֭��ά����C�ĺ�����500mg/L���ҡ�ijУ����С��ⶨ��ij���ӵ�����װ��֭��ά����C�ĺ����������Dzⶨʵ��������档(����д�йؿհ�)
��һ���ⶨĿ�ģ��ⶨ����������װ��֭��ά����C�ĺ�����
�������ⶨԭ����C6H8O6+I2 ��C6H6O6+2H��+2I�D
������ʵ����Ʒ���Լ�
��1����������Ʒ(��ѡ����)
��2���Լ���ָʾ��___(������)��Ũ��Ϊ7.50��10��3mol��L-1��I2����Һ������ˮ�ȡ�
���ģ�ʵ�����
��1��ϴ�����������ζ����Ƿ�©Һ����ϴ��װ�ñ�����Һ���á�
��2����___(����������)����ƿ������20.00mL�����֭������2��ָʾ����
��3�������ֿ��Ƶζ��ܵ�___(�λ)������ҡ����ƿ���۾�ע��___��ֱ���ζ��յ㡣�ζ����յ�ʱ��������___��
���壩���ݼ�¼�봦��������������Ʋ��������ݼ�¼�����ݴ����ı����������ݣ���__

�������ݴ������ζ������ı�����Һ�������15.00mL����˳�֭��ά����C�ĺ�����___mg/L��
�������������ۣ�
��1���ζ�ʱ�ܷ����ҡ����ƿ��Ϊʲô��_____
��2���ӷ������ݿ���������װ��֭�Ƿ��Ǵ���Ȼ��֭��___(��ǡ����ǡ������ǡ�)������������ܲ�ȡ��������____(����)��
A����ˮϡ����Ȼ��֭ B����֭�ѱ�Ũ�� C����ά����C��Ϊ���Ӽ�
���𰸡�������Һ ��ʽ�ζ��ܣ�����Һ�ܣ� ���� ��ƿ����Һ��ɫ�仯 ��Һ��ɫ����ɫ���Ұ�����ڲ��ָ�ԭɫ
���� ��� | ��ʼ(mL) | �յ�(mL) | ��V |
1 | |||
2 | |||
3 |
990 ���ܣ���ֹҺ�彦�� ���� C
��������
(1)���ݵζ�ԭ��C6H8O6+I2 ��C6H6O6+2H��+2I�D���õ�Һ�ζ�ά����C��Һ���������۱�����
��2������ά����Cˮ��Һ������ѡ��������
��3�����ݵζ������Ĺ淶�ش𣻵������һ�ε�Һʱ����Һ��ʣ�ࣻ
��4���ζ�������Ҫ��¼�ζ��ܿ�ʼ���յ�Ŀ̶ȣ�ʵ���ظ�2-3�Σ�
��5�����ݷ�Ӧ����ʽC6H8O6+I2 ��C6H6O6+2H��+2I�D����˳�֭��ά����C�ĺ�����
��6������ҡ����ƿ��Һ��������
(7)������Ȼ��֭��ά����C�ĺ����жϣ�
(1)���ݵζ�ԭ��C6H8O6+I2 ��C6H6O6+2H��+2I�D���õ�Һ�ζ�ά����C��Һ������ѡ���ָʾ���ǵ�����Һ��
��2������ά����Cˮ��Һ�����ԣ�����ʽ�ζ��ܣ�����Һ�ܣ�����ƿ������20.00mL�����֭��
��3�������ֿ��Ƶζ��ܵĻ���������ҡ����ƿ���۾�ע����ƿ����Һ��ɫ�仯��ֱ���ζ��յ㡣�ζ����յ�ʱ�������ǵ������һ�ε�Һ��Һ����ɫ����ɫ���Ұ�����ڲ��ָ�ԭɫ��
��3���ζ�������Ҫ��¼�ζ��ܿ�ʼ���յ�Ŀ̶ȣ�ʵ���ظ�2-3�Σ�����Ϊ
���� ��� | ��ʼ(mL) | �յ�(mL) | ��V |
1 | |||
2 | |||
3 |
��
��5����20.00mL�����֭��ά����C�ĺ���Ϊxmol��
C6H8O6 + I2 �� C6H6O6 + 2H��+ 2I�D
1 1
7.50��10��3mol��L-1��0.015L x
X=1.125��10��4mol
�˳�֭��ά����C�ĺ�����![]() 0.99g/L=990mg/L��
0.99g/L=990mg/L��
��6��Ϊ��ֹҺ�彦�����ζ�ʱ���ܾ���ҡ����ƿ��
(7)���ʳ�֭��ά����C�ĺ�����500mg/L���ң���������װ��֭ά����C�ĺ�����990mg/L�����Բ��Ǵ���Ȼ��֭����ˮϡ����Ȼ��֭��ά����C�����ή�ͣ���֭�ѱ�Ũ��������˳ɱ�����ά����C��Ϊ���Ӽ������ά���صĺ�������ѡC��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
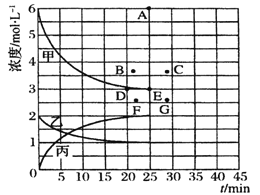
����Ŀ����ҵ�ϳɰ���ӦΪNz(g)+3H2(g) ![]() 2NH3(g)�������о�����:��773 Kʱ���ֱ�2 mol N2��6 mol H2����һ���̶��ݻ�Ϊ1L ���ܱ������У����ŷ�Ӧ�Ľ��У�����������n(H2)��n(NH3)�뷴Ӧʱ��t�Ĺ�ϵ���±�;
2NH3(g)�������о�����:��773 Kʱ���ֱ�2 mol N2��6 mol H2����һ���̶��ݻ�Ϊ1L ���ܱ������У����ŷ�Ӧ�Ľ��У�����������n(H2)��n(NH3)�뷴Ӧʱ��t�Ĺ�ϵ���±�;
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n��H2��/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n��NH3��/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(1) ǰ10min ������N2��ʾ�ķ�Ӧ����Ϊ________
(2) ���¶��£��˷�Ӧ��ƽ�ⳣ��K=__________
(3) ���¶��£�����ͬ�ݻ�����һ������Ͷ���N2��H2��NH3��Ũ�ȷֱ�Ϊ3 mol��L-1��3 mol��L-1��3 mol��L-1�����ʱv��_______v��(����>������<������=��)��
(4) ���¶��£�������ƽ����ϵ����ͨ��2molNH3��һ��ʱ��ﵽ�µ�ƽ�⡣��ʱc(H2)____ 4.5mo1/L(����>������<������=��)��
(5) ���ϱ��е�ʵ�����ݼ���õ���Ũ��-ʱ�����Ĺ�ϵ������ͼ�е����߱�ʾ����ʾc(N2)-t��������______���ڴ��¶��£�����ʼ����4 mol Nz ��12 mol Hz,��Ӧ�մﵽƽ��ʱ����ʾc(H2)-t����������Ӧ�ĵ�Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵����ȷ����
A.0.5mol/L��MgCl2��Һ�У�����Cl- ����ΪNA
B.0.1 mol Zn�뺬0.1 mol HCl�������ַ�Ӧ������H2�����Ϊ112mL
C.���³�ѹ�£�3.2 g O2������ԭ����Ϊ0.2NA
D.��״���£�2.24 LH2O���е�H2O������Ϊ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
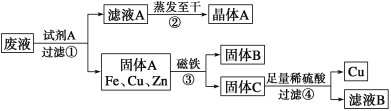
����Ŀ��ij�����ӹ����ŷŵ���ˮ�к���CuSO4��ZnSO4��FeSO4��ij�о�С�����ø���ˮ���չ�ҵ��Ҫԭ������п���йؽ��������������£�
��ش��������⣺
(1)����˵����ȷ����________��
A���ù��������з�����3���û���Ӧ
B��CuSO4��Mg(OH)2�������ֽⷴӦ�ɵ�Cu(OH)2
C������٢ڢۢܶ�������ѧ�仯
(2)д������ٷ�����Ӧ�����ӷ���ʽ��__________________��_________________
(3)������м�������ϡ�����Ŀ����________________
(4)��ҺB���еķ�ɢ��Ϊ____________��___________ .
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ij��ͯ��Ԫ����챨�浥�IJ������ݣ��������ݣ��ش��������⣺
������ҽ�ƻ����ٴ����������浥 | ||||
������Ŀ | ����� | ��λ | �ο���Χ | |
1 | п(Zn) | 115.92 |
| 66~120 |
2 | ��(Fe) | 6.95�� |
| 7.52~11.82 |
3 | ��(Ca) | 1.68 |
| 1.55~2.10 |
(1)�ö�ͯ����_________Ԫ�غ���ƫ�͡�
(2)���浥������mol��L��1����__________(���������������������Ũ����)�ĵ�λ��
(3)����ά����C��ʹʳ���е�Fe3��ת��ΪFe2�������������������ά����C��________�ԡ�
(4)ȱ����ƶѪ����Ӧ����Fe2����һЩ����������������Ϊ��Ҫ�ɷ֣������������Ƴ�ҩƬʱ�������һ����������£��Ʋ����µ�������_______________________��
(5)ȡ��Ѫ��Ƭ���в���ϸ���������ϡ���ᣬȡ����Һ��Ȼ��μ�KSCN��Һ������Һ��Ϊ��ɫ������Һ�к���________(�����ӷ���)��˵����Ѫ���Ƿ����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������Fe��FeO��Fe2O3��Fe3O4�Ļ�����м���350mL 2molL��1��ϡ����ǡ��ʹ�������ȫ�ܽ⣬�ų�2.24L NO����״��������������Һ�м���KSCN��Һ����ɫ���֣�����������H2�ڼ��������»�ԭ��ͬ�����Ļ������õ����������ʵ���Ϊ�� ��
A. 0.21 molB. 0.25 molC. 0.3 molD. 0.35 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ���������й㷺��Ӧ�á�CuCl2��CuCl�����ֳ������Σ��㷺Ӧ���ڹ�ҵ������
I. CuCl2������ˮ��ˮ�⡣ʵ��������ͼ��ʾ��ʵ��������ҩƷ���Ʊ�����������������������ͭ��������������Ӧ�Ʊ��Ȼ�ͭ������̨�����м��ƾ���ʡ�ԣ���

��1��д��װ��A�У�������Ӧ�Ļ�ѧ��Ӧ����ʽ��____��װ��C��������____
��2���������ʵ�飬�������������Ӹ������ӿڵ�˳����a��___����ÿ��������ʹ��һ�Σ�
��3������Dװ�õ�������____
��. CuCl��Ӧ�ù㷺���л��ϳɴ������ɲ�ȡ��ͬ������ȡ��CuCl����ʰ�ɫ��¶���ڳ�ʪ�������ױ�������
����һ���������Ƶõ��Ȼ�ͭ��Һ��ͨ��SO2������һ��ʱ�伴���Ƶ�CuCl��д���÷�Ӧ�����ӷ���ʽ��___��
��������ͭ�ۻ�ԭCuSO4��Һ
![]()
��֪��CuCl������ˮ���Ҵ�����ˮ��Һ�д���ƽ�⣺CuCl(��ɫ)+2Cl��![]() [CuCl3]2��(��ɫ��Һ)��
[CuCl3]2��(��ɫ��Һ)��
��1�����У����������¶Ȳ��˹��ߺ��ͣ�Ŀ����___�����۲쵽__����������Ӧ�Ѿ���ȫ��
��2�����У��������ˮ��������___������ƽ��ǶȽ��ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ���ɳ���Ԫ����ɵ�һЩ���ʼ��仯����֮���ת����ϵͼ���������ʾ�йص�һ�ַ�Ӧ�����������������Ѿ���ȥ��������A��B��D�ڳ����¾�Ϊ��ɫ��ζ�����壬C����ʹʪ��ĺ�ɫʯ����ֽ���������壬M���������ɫҺ�塣

��1��д��C��E�Ļ�ѧ����ʽ�� ��
��2��ʵ���ҳ��ü������ֹ�������ķ����Ʊ�����C���仯ѧ����ʽΪ�� ������C���� ����д�Լ����ƣ���
��3��E��������D����ʱ����۲쵽 ����������ˮ���ռ�F�������ռ���ƿ���ռ���������Ϊ ����д���ʵĻ�ѧʽ����
��4��д��A��D�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС�����Ʊ�Ħ����[(NH4)2Fe(SO4)2��6H2O]��̽����ֽ����鵽������Ϣ��
Ħ���ο���FeSO4��Һ��(NH4)2SO4��Һ����Ʊ���������������ˮ���������Ҵ����ڿ���������������100����ʼ�ֽ⣬�ҷֽ�����к�����������������������ˮ�����ȡ�
I.�Ʊ�Ħ����
(1)�����Ƶ�FeSO4��Һ�м���(NH4)2SO4���壬���ȣ�ʵ���������ò���___________���ȷ�ʽ��
(2)����Ũ������ȴ�ᾧʹĦ���νᾧ������������˺���_____________ϴ�ӡ�
(3)��С���õζ������Ʒ���ȡ��ֳ�ȡa g�ò�Ʒ����ƿ�У�������ˮ�ܽ⣬��0.1000mol/L����KMnO4��Һ�ζ�������ζ��յ�ʱ������KMnO4��Һ20.00 mL����ò�Ʒ�Ĵ���Ϊ____________��
II.̽��Ħ�������ȷֽ�IJ���
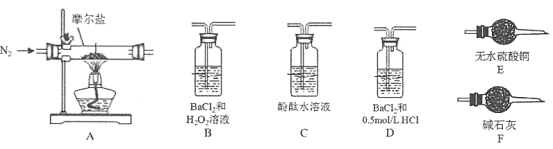
(4)��֤�ֽ�����к��а�����ˮ��������̽����������ɷ֡�
����ѡ��װ�õ���ȷ����˳��Ϊ___________��(��ѡ������������װ�õ���ĸ���)
��A�й�����ȫ�ֽ���Ϊ����ɫ��ĩ�����ʵ��֤��A�в��������ΪFe2O3��������FeO��Fe3O4______________________��
(5)̽���ֽ�����е����������A��D��B��F��˳������װ�ã�����ʵ�顣
��Dװ�����Լ���������____________________________________________��
��ʵ������У���B���г������ɣ�����ʵ��֤��Ħ�������ȷֽ�����������⣬����N2���ɡ�д��Ħ�������ȷֽ�Ļ�ѧ����ʽ__________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com