


科目:高中化学 来源: 题型:
| 实验序号 | a | b | c |
| 合金质量/mg | 510 | 765 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
查看答案和解析>>
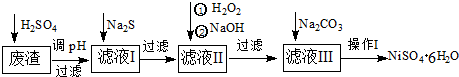
科目:高中化学 来源: 题型:
查看答案和解析>>
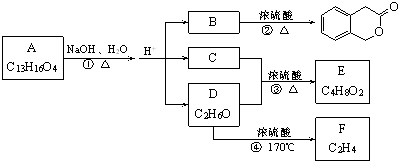
科目:高中化学 来源: 题型:
查看答案和解析>>
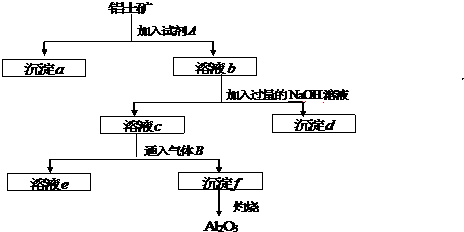
科目:高中化学 来源: 题型:
查看答案和解析>>
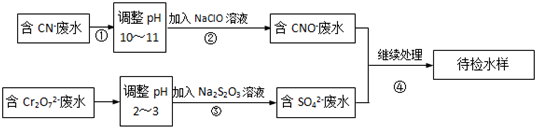
科目:高中化学 来源: 题型:
| A、配制酸性KMnO4溶液时,用盐酸酸化 |
| B、用水湿润pH试纸测量某溶液的pH值 |
C、实验室用右图所示装置除去Cl2中的少量HCl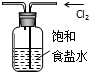 |
| D、用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | CH3CH3 | CH2=CH2 | H2 | 加热 |
| B | CH3COOCH2CH3 | CH3COOH | Na2CO3 | 蒸馏 |
| C | CH3CH2OH | H2O | CaO | 蒸馏 |
| D | CH3COOH | CH3CH2OH | Na2CO3 | 分液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、遇苯酚变紫色的溶液:Na+、Mg2+、SO42-、H2O2 |
| B、0.1 mol?L-1 (NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl-、Fe3+ |
| C、使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Cl- |
| D、0.1mol?L-1 NaHCO3溶液:K+、AlO2-、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c2(NO2) |
| c2(NO)c(O2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com