
【题目】青蒿素是高效的抗疟疾药,为无色针状晶体,易溶于丙酮、氯仿和苯中,甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157°C,热稳定性差。已知:乙醚沸点为35°C。提取青蒿素的主要工艺为:

下列有关此工艺操作错误的是( )
A.破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素浸取率
B.操作Ⅰ需要用到的玻璃仪器有漏斗、玻璃棒、烧杯
C.操作Ⅱ是蒸馏,利用了乙醚与青蒿素的沸点相差较大
D.操作Ⅲ的主要过程加水溶解,蒸发浓缩、冷却结晶、过滤
【答案】D
【解析】
对青蒿进行干燥破碎,可以增大青蒿与乙醚的接触面积,提高青蒿素的浸取率,用乙醚对青蒿素进行浸取后,过滤,可得滤液和滤渣,提取液经过蒸馏后可得青蒿素的粗品,对粗品可加95%的乙醇,浓缩、结晶、过滤可得精品,据此分析作答。
根据上述分析可知,
A. 破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素浸取率,故A正确;
B. 操作Ⅰ为过滤,需要用到的玻璃仪器有漏斗、玻璃棒、烧杯,故B正确;
C. 操作Ⅱ是蒸馏,利用了乙醚与青高素的沸点相差较大,故C正确;
D. 根据给定信息可知,青蒿素在水中几乎不溶,因此操作Ⅲ的主要过程不是加水溶解,可加95%的乙醇溶解,再进行蒸发浓缩、冷却结晶、过滤,故D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】把含硫酸铵和硝酸铵的混合液a L分成两等份.一份加入含b mol NaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗c mol BaCl2才能使SO42﹣完全沉淀,则原溶液中NO3﹣的物质的量浓度为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验探究亚硝酸钠(NaNO2)的化学性质(AgNO2是淡黄色难溶于水的固体)
实验 | 装置 | 试剂a | 现象 |
① |
| 酚酞 | 无色溶液变红 |
② | AgNO3溶液 | 产生淡黄色沉淀 | |
③ | 淀粉KI 溶液+稀硫酸 | 无色溶液立即变蓝 | |
④ | 酸性K2Cr2O7溶液 | 无色溶液变为绿色 |
由上述实验所得结论不正确的是
A.NaNO2溶液呈碱性:NO2-+H2OHNO2+OH-
B.NaNO2可与某些盐发生复分解反应:NO2-+Ag+=AgNO2↓
C.NaNO2有氧化性:2I-+2H++2NO2-=I2+2NO2↑+H2O
D.NaNO2有还原性:Cr2O72-+3NO2-+8H+=3NO3-+2Cr3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】翡翠是玉石中的一种,其主要成分为硅酸铝钠NaAl(Si2O6),常含微量Cr、Ni、Mn、Mg、Fe等元素。请回答下列问题:
(1)基态镍原子的外围电子排布图为___________;与其同周期的基态原子的M层电子全充满的元素位于周期表的__________、___________区。
(2)翡翠中主要成分硅酸铝钠中四种元素电负性由小到大的顺序是___________。
(3)铬可以形成CrCl3·x NH3(x=3、4、5、6)等一系列配位数为6的配合物。
①NH3分子的ⅤSEPR模型是___________。
②键角大小关系NH3___________PH3(填“>”<”或“=”)。
③NF3不易与Cr3+形成配离子,其原因是___________。
(4)铁有δ、γ、α三种同素异形体,如下图所示。
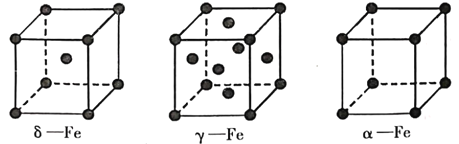
γ-Fe晶体的一个晶胞中所含有的铁原子数为___________,δ-Fe、α-Fe两种晶胞中铁原子的配位数之比为___________。已知δ-Fe晶体的密度为dg/cm,NA表示阿伏伽德罗常数的数值,则Fe原子半径为___________pm(列表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从矿物学资料查得,一定条件下FeS2(二硫化亚铁)存在反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
A.Cu2S既是氧化产物又是还原产物
B.5 mol FeS2参加反应,有10 mol电子转移
C.FeS2只作还原剂
D.产物中的![]() 有一部分是氧化产物
有一部分是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现NOx和SO2是雾霾的主要成分。
I.NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g)![]() 2NO(g) △H=+180 kJ· mol-1
2NO(g) △H=+180 kJ· mol-1
2CO(g)+O2(g)![]() 2CO2(g) △H=-564 kJ· mol-1
2CO2(g) △H=-564 kJ· mol-1
(1)2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) △H=___________,该反应在___________下能自发进行(填“高温”低温”或“任意温度”)
2CO2(g)+N2(g) △H=___________,该反应在___________下能自发进行(填“高温”低温”或“任意温度”)
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程0-5min中NO的物质的量随时间变化如右图所示。
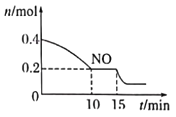
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为P=14MPa,则T℃时该反应的压力平衡常数Kp=___________MPa-1;平衡后,再向容器中充入NO和CO2各0.1mol,平衡将___________(填“向左”“向右”或“不")移动
②15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是___________(填字母)
A.升温 B.增大CO浓度 C.加入催化剂 D减小容器体积
Ⅱ.SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。
(1)已知:亚硫酸的电离常数为Ka1=2.0×10-2,Ka2=6.0×10-7。则NaSO3溶液呈___________(填“酸性”、“中性”或“碱性”)
(2)如图所示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为___________;若通入的N体积为4.48L(标况下),则另外一个电极通入SO2的质量理论上应为__________g。
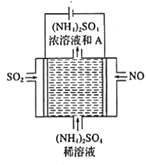
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】翡翠是玉石中的一种,其主要成分为硅酸铝钠NaAl(Si2O6),常含微量Cr、Ni、Mn、Mg、Fe等元素。请回答下列问题:
(1)基态镍原子的外围电子排布图为___________;与其同周期的基态原子的M层电子全充满的元素位于周期表的__________、___________区。
(2)翡翠中主要成分硅酸铝钠中四种元素电负性由小到大的顺序是___________。
(3)铬可以形成CrCl3·x NH3(x=3、4、5、6)等一系列配位数为6的配合物。
①NH3分子的ⅤSEPR模型是___________。
②键角大小关系NH3___________PH3(填“>”<”或“=”)。
③NF3不易与Cr3+形成配离子,其原因是___________。
(4)铁有δ、γ、α三种同素异形体,如下图所示。
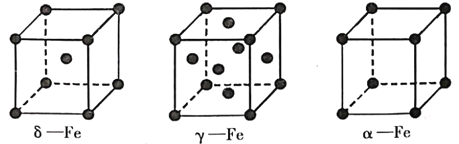
γ-Fe晶体的一个晶胞中所含有的铁原子数为___________,δ-Fe、α-Fe两种晶胞中铁原子的配位数之比为___________。已知δ-Fe晶体的密度为dg/cm,NA表示阿伏伽德罗常数的数值,则Fe原子半径为___________pm(列表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语或名称表述不正确的是( )
A.葡萄糖的分子式:C6H12O6
B.HCl的电子式:![]()
C. 的名称:2﹣甲基丙烷
的名称:2﹣甲基丙烷
D.含有10个中子的氧原子可表示为:![]() O
O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是
A. 实验I、II、III中均涉及Fe3+被还原
B. 对比实验I、II说明白色沉淀的产生与铜粉的量有关
C. 实验II、III中加入蒸馏水后c(Cu2+)相同
D. 向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com