
【题目】工业上利用铁的氧化物在高温条件下循环裂解水制氢气的流程如下图所示。
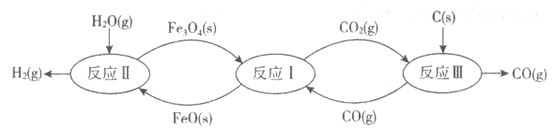
(1)反应I的化学方程式为:Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g),反应Ⅱ的化学方程式为_________,对比反应I、Ⅱ,铁的氧化物在循环裂解水制氢气过程中的作用是_________。用化学方程式表示反应I、Ⅱ、Ⅲ的总结果:_________。
3FeO(s)+CO2(g),反应Ⅱ的化学方程式为_________,对比反应I、Ⅱ,铁的氧化物在循环裂解水制氢气过程中的作用是_________。用化学方程式表示反应I、Ⅱ、Ⅲ的总结果:_________。
(2)反应III为:CO2(g)+C(s)![]() 2CO(g)
2CO(g) ![]() H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有_________(任写一条措施)。
H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有_________(任写一条措施)。
(3)上述流程中铁的氧化物可用来制备含有Fe3+的刻蚀液,用刻蚀液刻蚀铜板时,可观察到溶液颜色逐渐变蓝,该反应的离子方程式为_________。刻蚀液使用一段时间后会失效,先加酸,再加入过氧化氢溶液,可实现刻蚀液中Fe3+的再生,该反应的离子方程式为_________。
(4)上述流程中碳的氧化物可用来制备碳酰肼[CO(NHNH2)2,其中碳元素为+4价]。加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳。该反应的化学方程式为_________。
【答案】3FeO(s)+H2O(l) ![]() H2(g)+Fe3O4(s) 催化剂 C(s)+H2O(g)=CO(g)+H2(g)(方程不写状态,写可逆号亦可) 升高温度,减小压强,移走CO,加入CO2等 2Fe3++Cu=2Fe2++Cu2+ H2O2+2Fe2++2H+=2H2O+2Fe3+ CO(NHNH2)2+12Fe2O38Fe3O4+2N2↑+CO2↑+3H2O
H2(g)+Fe3O4(s) 催化剂 C(s)+H2O(g)=CO(g)+H2(g)(方程不写状态,写可逆号亦可) 升高温度,减小压强,移走CO,加入CO2等 2Fe3++Cu=2Fe2++Cu2+ H2O2+2Fe2++2H+=2H2O+2Fe3+ CO(NHNH2)2+12Fe2O38Fe3O4+2N2↑+CO2↑+3H2O
【解析】
(1)由流程图可获取化学反应的反应物和生成物相关信息,再结合原子守恒和电子守恒进行分析解答;
(2)反应III为:CO2(g)+C(s)![]() 2CO(g) ΔΗ>0,该反应正反应为一个气体分子数目增多的吸热反应,提高达平衡后CO的产量,则需要促使平衡正向移动,由化学平衡移动原理分析解答;
2CO(g) ΔΗ>0,该反应正反应为一个气体分子数目增多的吸热反应,提高达平衡后CO的产量,则需要促使平衡正向移动,由化学平衡移动原理分析解答;
(3)用刻蚀液刻蚀铜板时的反应为:2Fe3++Cu=2Fe2++Cu2+,刻蚀液中Fe3+的再生,即将亚铁离子氧化又生成铁离子,由此解答;
(4)由题给信息分析出该反应的反应物和生成物,再结合氧化还原反应方程式的配平方法可解答。
(1)由流程图可知反应II的反应物为FeO(s)和H2O(g),生成物为H2(g)和Fe3O4(s),配平可得方程式3FeO(s)+H2O(g)![]() H2(g)+Fe3O4(s);反应I为:Fe3O4(s)+CO(g)
H2(g)+Fe3O4(s);反应I为:Fe3O4(s)+CO(g) ![]() 3FeO(s)+CO2(g),反应II为:3FeO(s)+H2O(g)
3FeO(s)+CO2(g),反应II为:3FeO(s)+H2O(g)![]() H2(g)+Fe3O4(s),综合两反应可知铁的氧化物虽然参与了反应,但在反应前后并没有发生变化,起到催化剂的作用;由流程图可知,整个过程的反应物为C(s)和H2O(g),生成物为CO(g)和H2(g),则反应I、II、III的总结果为:C(s)+H2O(g)
H2(g)+Fe3O4(s),综合两反应可知铁的氧化物虽然参与了反应,但在反应前后并没有发生变化,起到催化剂的作用;由流程图可知,整个过程的反应物为C(s)和H2O(g),生成物为CO(g)和H2(g),则反应I、II、III的总结果为:C(s)+H2O(g)![]() CO(g)+H2(g);故答案为:3FeO(s)+H2O(g)
CO(g)+H2(g);故答案为:3FeO(s)+H2O(g) ![]() H2(g)+Fe3O4(s)、催化剂、C(s)+H2O(g)
H2(g)+Fe3O4(s)、催化剂、C(s)+H2O(g)![]() CO(g)+H2(g)(方程不写状态,写可逆号亦可) ;
CO(g)+H2(g)(方程不写状态,写可逆号亦可) ;
(2)反应III为:CO2(g)+C(s)![]() 2CO(g) ΔΗ>0,该反应正反应为一个气体分子数目增多的吸热反应,提高达平衡后CO的产量,则需要促使平衡正向移动,由化学平衡移动原理可知;在其它条件不变时,升高温度、减小压强、移走CO或加入CO2等都可使平衡正向移动,提高达平衡后CO的产量,故答案为:在其它条件不变时,升高温度、减小压强、移走CO或加入CO2等(任写一条措施);
2CO(g) ΔΗ>0,该反应正反应为一个气体分子数目增多的吸热反应,提高达平衡后CO的产量,则需要促使平衡正向移动,由化学平衡移动原理可知;在其它条件不变时,升高温度、减小压强、移走CO或加入CO2等都可使平衡正向移动,提高达平衡后CO的产量,故答案为:在其它条件不变时,升高温度、减小压强、移走CO或加入CO2等(任写一条措施);
(3)用刻蚀液刻蚀铜板时,可观察到溶液颜色逐渐变蓝,是因为生成了Cu2+,发生的离子反应为:2Fe3++Cu=2Fe2++Cu2+;在酸性条件下,双氧水可将Fe2+氧化生成Fe3+,从而实现刻蚀液的再生,发生的离子反应为:H2O2+2Fe2++2H+=2H2O+2Fe3+;故答案为:2Fe3++Cu=2Fe2++Cu2+;H2O2+2Fe2++2H+=2H2O+2Fe3+;
(4)由题给信息可知该反应的反应为:CO(NHNH2)2和Fe2O3,生成物有Fe3O4、N2、CO2、H2O等,由氧化还原反应的规律配平可得方程式CO(NHNH2)2+12Fe2O38Fe3O4+2N2↑+CO2↑+3H2O;故答案为:CO(NHNH2)2+12Fe2O38Fe3O4+2N2↑+CO2↑+3H2O。


科目:高中化学 来源: 题型:
【题目】已知:2H2+O2![]() 2H2O。
2H2O。
(1)该反应1g氢气完全燃烧放出热量121.6kJ,其中断裂1molH-H键吸收436kJ,断裂1molO=O键吸收496kJ,那么形成1molH-O键放出热量____________________。
(2)原电池是直接把化学能转化为电能的装置。
I.航天技术上使用的氢-氧燃料电池具有高能、轻便和不污染环境等优点。下图是氢-氧燃料电池的装置图。则:

①溶液中OH-移向________电极(填“a”或“b”)。
②b电极附近pH_____________。(填增大、减小或不变)
③如把H2改为甲烷,则电极反应式为:正极:____________________________,负极:________________________________。
II.将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g,试计算:产生氢气的体积___________________________________L。(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
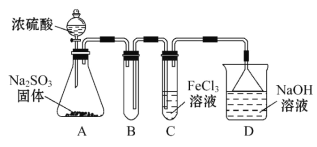
(1)通入足量SO2时C中观察到的现象为_____________________________。
(2)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式______________________________;
②请设计实验方案检验有Fe2+生成_________________________。
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法_______(填“合理”或“不合理”),理由是____________
(3)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填序号)。
A.浓硫酸 B.酸性KMnO4溶液 C.碘水 D.NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH3COONa溶液中存在水解平衡:CH3COO-+H2O![]() CH3COOH+OH-,下列说法正确的是
CH3COOH+OH-,下列说法正确的是
A. 加入少量NaOH固体,c(CH3COO-)减小
B. 加入少量FeCl3固体,c(CH3COO-)减小
C. 稀释溶液,溶液的pH增大
D. 加入适量醋酸得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。右图为RFC工作原理示意图,下列有关说法正确的是
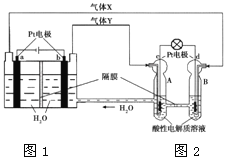
A. 图1把化学能转化为电能,图2把电能转化为化学能,水得到了循环使用
B. 当有0.1 mol电子转移时,a极产生0.56 L O2(标准状况下)
C. c极上发生的电极反应是:O2+ 4H++ 4e-= 2H2O
D. 图2中电子从c极流向d极,提供电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 硫化亚铁与稀硝酸混合反应:2H++FeS=H2S↑+ Fe2+
B. 酸化NaIO3和NaI的混合溶液,滴入几滴淀粉溶液变蓝色:5I +IO3+6H+![]() 3I2+3H2O
3I2+3H2O
C. Ba(OH)2与等物质的量 NaHSO4混合:Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Al2H6燃烧热极高,是一种很好的生氢剂,它跟水反应生成H2,球棍模型如图(白球为Al,黑球为H)。下列推测肯定不正确的是
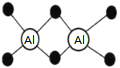
A. 该物质与水反应,属于氧化还原反应
B. Al2H6分子中氢为+1价,铝为﹣3价
C. Al2H6在空气中完全燃烧,产物为氧化铝和水
D. 氢铝化合物可能成为未来的储氢材料和火箭燃料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com