
| 0.72g |
| 18g/mol |
| 2.2g |
| 44g/mol |
| 2×5+2-8 |
| 2 |
| 32g |
| 160g/mol |
| 0.72g |
| 18g/mol |
| 2.2g |
| 44g/mol |
| 2×5+2-8 |
| 2 |
| 32g |
| 160g/mol |
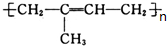 ,名称是聚2-甲基-1,3-丁二烯,
,名称是聚2-甲基-1,3-丁二烯,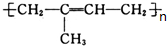 ;聚2-甲基-1,3-丁二烯.
;聚2-甲基-1,3-丁二烯.


科目:高中化学 来源: 题型:
| A、同周期的主族元素中,ⅦA族元素的原子半径最小 |
| B、碳族元素都是非金属元素,其非金属性随核电荷数的增加而减弱 |
| C、元素周期表中从ⅢB到ⅡB十个纵列的元素都是金属元素 |
| D、ⅠA族元素的原子,其半径越大,越容易失去电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 粒子代码 | X | Y | Z | W |
| 原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
| 粒子的电荷数 | 0 | 0 | 两负电荷 | 0 |
| 丁 |
| 反应① |
| 丁 |
| 反应② |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
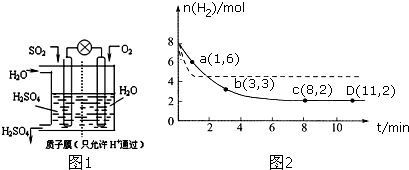
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
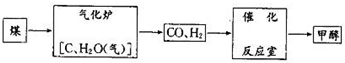
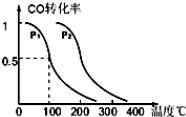
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com