
 (1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
| ||
| ||


科目:高中化学 来源: 题型:
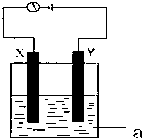
| A、X与Y形成的化合物的化学式可能为Y2X2 |
| B、X的化合物种类比Y的化合物种类多 |
| C、Y能置换出酸中的氢,却不能置换出盐溶液中的金属 |
| D、X和Y都是性质很活泼的元素,在自然界中都只能以化合态形式存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | |||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | C | N | O | ||||
| 3 | Na | Al | Si | S | Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在0.1mol?L-1的H2A溶液中,c(H+)>0.12mol?L-1 |
| B、在0.1mol?L-1的Na2A溶液中,c(A2-)+c(HA-)+c(Na+)=0.2mol?L-1 |
| C、分别将同浓度(0.1mol?L-1)的NaHA和Na2A溶液等体积混合,其pH一定小于7 |
| D、0.1mol?L-1的NaHA溶液中离子浓度为:c(Na+)>c(H+)>c(HA-)>c(A2-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NH4HCO3溶液中加过量Ca(OH)2溶液:HCO3-+OH-+Ca2+═CaCO3↓+H2O | ||||
B、用惰性电极MgCl2电解水溶液:2Cl-+2H2O
| ||||
| C、向偏铝酸钠溶液中加入少量硫酸氢钠溶液:AlO2-+H++H2O═Al(OH)3↓ | ||||
| D、浓盐酸跟二氧化锰混合共热:MnO2+4H++4Cl-═MnO2++2H2O+2Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com