
| 4×10-12 |
| 0.02 |
| 0.04mol-0.02 |
| 0.2L |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
| A、向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
| B、Cl2与水的反应:Cl2+H2O═2H++Cl-+ClO- |
| C、醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
| D、FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 部分电离的物质 | H2O | NH3?H2O(一水合氨) | HClO(次氯酸) |
| 电离产生的离子 | H+和OH- | NH4+和OH- | H+和ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
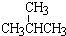 和
和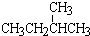 ;②正戊烷和
;②正戊烷和 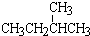 ;③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3)
;③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
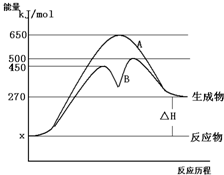 反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该温度为常温25℃ |
| B、由水电离出来的H+的浓度是1.0×10-12mol?L-1 |
| C、加入NaHSO4晶体抑制了水的电离 |
| D、该温度下加入等体积浓度为0.01 mol/L的NaOH溶液可使该溶液恰好呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com