
【题目】某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质:

(1)装置A中烧瓶内试剂可选用________(填序号)。
a.浓硫酸 b.碱石灰 c.五氧化二磷 d.NaOH固体
(2)若探究氨气的溶解性,标准状况下,装置D中收集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是________;完成喷泉实验后,装置D中充满液体,则装置D中溶液的物质的量浓度为__________。(保留两位有效数字)
(3)K2的导管末端需要连接氨气的吸收装置,则不能在K2的导管末端连接如图中的________装置(填序号Ⅰ、Ⅱ、Ⅲ)。
备选装置(其中水中含酚酞试液) | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
(4)若探究氨气的还原性,需关闭K1、K3,K2处导管连接制取纯净、干燥氯气的装置。
①D中氨气与氯气反应产生白烟,同时生成一种化学性质稳定气体单质,该反应可用来检验氯气管道是否有泄漏,则该反应的化学方程式为______。
②尾气可用C装置处理,若尾气中含有少量Cl2,则C装置中吸收氯气发生的化学方程式为_____。
【答案】bd 用热毛巾捂住烧瓶一段时间 0.045 mol/L I 8NH3 + 3Cl2 = N2 + 6NH4Cl Cl2+2NaOH=NaCl+NaClO+H2O
【解析】
(1) a.浓硫酸与氨水反应生成硫酸铵和水,不行,a错误;
b.碱石灰遇水放热,温度升高,一水合氨分解产生氨气,b正确;
c.五氧化二磷是酸性氧化物,把氨水反应了,c错误;
d.NaOH固体遇水放热,温度升高,一水合氨分解产生氨气,d正确;
故答案为:bd;
(2)想办法让一部分氨气与烧杯中的水接触,可用热毛巾捂住烧瓶一段时间,可引发喷泉实验,设烧瓶D的体积为1L,则氨气的物质的量=![]() mol,溶于水后溶质的物质的量浓度=
mol,溶于水后溶质的物质的量浓度=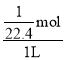 ≈0.045mol/L,故答案为:用热毛巾捂住烧瓶一段时间;0.045 mol/L;
≈0.045mol/L,故答案为:用热毛巾捂住烧瓶一段时间;0.045 mol/L;
(3)氨气极易溶于水,易引发倒吸,要加防倒吸装置,Ⅱ和Ⅲ均可防倒吸,Ⅰ不行,故答案为:Ⅰ;
(4)①氯气有强氧化性,氨气中N的化合价为-3,有还原性,被氯气氧化成稳定的氮气,氯气被还原成-1价,另一个产物为NH4Cl,所以,反应的方程式为:8NH3 + 3Cl2 = N2 + 6NH4Cl,故答案为:8NH3 + 3Cl2 = N2 + 6NH4Cl;
②吸收氯气常用NaOH溶液,故反应的方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】近日,我国科研团队研发出一种蓝藻人造叶片系统,其核心是一种可以向细胞外分泌蔗糖的蓝藻,其工作原理如图。下列说法不正确的是

A. 该系统利用了蓝藻的光合作用
B. 理论上,系统出水量小于进水量
C. 可用银氨溶液检验产物中是否含蔗糖
D. 该系统有望为人类探索太空时解决生存难题提供新思路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气。若砷的质量为1.50 mg,则( )
A. 被氧化的砒霜为1.98 mg
B. 分解产生的氢气为 0.672 mL
C. 和砒霜反应的锌为3.90 mg
D. 生成砷化氢时,转移的电子总数为6×10-5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用相关原理,回答下列各小题:
(1)25℃时,某FeCl3溶液的pH=2,则此溶液中由水电离产生的c(OH-)=___________;用离子方程式表示FeCl3溶液用于净水的原因:______________________。
(2)已知NaHSO4在水中的电离方程式 NaHSO4 = Na++H++SO42-。在NaHSO4溶液中c(H+)______c(OH-)+c(SO42-)(填“>”、“=”或“<”下同);用硫酸氢 钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH______7
(3)分析下表提供的数据:
化学式 | 电离常数 |
HClO | Ka=3×10-8 |
H2CO3 | Ka1=4.3×10-7 |
Ka2=5.6×10-11 |
①84消毒液(有效成分为NaClO)久置于空气中会失效,写出发生反应的离子方程式: _____________________________________________
②判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度由大到小的顺序: ____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地奥司明片是治疗静脉淋巴功能不全相关的各种症状(腿部沉重、疼痛、晨起酸胀不适感)的主要治疗药物,下图为合成地奥司明片重要中间体,下列有关说法正确的是( )

A. 分子式为C18H20O6
B. 该中间体是高分子化合物
C. 该中间体可发生水解反应生成乙醇
D. 该中间体分子在一定条件下可以发生取代、加成、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是重要的过渡元素。
(1)钴位于元素周期表中第___族,基态钴原子中未成对电子的个数为_____。
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中中心离子Fe3+的核外价电子排布式为___;尿素分子中氮原子的杂化方式是___,尿素中所含非金属元素的电负性由大到小的顺序是___。
(3)Co(NH3)5BrSO4可形成两种结构的钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:
在第一种配合物溶液中加硝酸银溶液产生白色沉淀。
在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀,则第二种配合物的配体为_____。
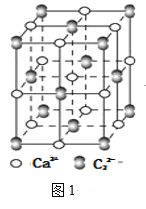
(4)离子化合物CaC2的一种晶体结构如图1所示,从钙离子看,属于____堆积,其配位数是_____;一个晶胞中平均含有的π键的个数为_____。
(5)科学研究结果表明。碳的氧化物CO2能够与H2O借助于太阳能制备HCOOH,其反应原理如下:2CO2+2H2O=2HCOOH+O2,则生成的HCOOH分子中σ键和π键的个数比是____。
(6)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞如图2所示,则该物质的化学式为______,若晶体密度为ρg/cm3,则晶胞中最近的两个碳原子的距离为_____pm(阿伏加德罗常数的值用NA表示,写出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质:

填写下列空白:
(1)下列试剂能与甲反应而褪色的是_____(填标号)
a.Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:___________________。
(3)淀粉通过下列转化可以得到乙(其中A~D均为有机物):
淀粉![]() A
A![]() B
B![]() C
C![]() D
D![]() 乙
乙
A的分子式是_________________,试剂X可以是___________________。
已知:
![]() +RCl
+RCl ![]()
![]() +HCl(-R为烃基);
+HCl(-R为烃基);
![]()
![]()
 +H2
+H2
(4)根据上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,写出其中属于取代反应的化学方程式__________________________________________________________________。
(5)化合物丁含碳、氢、氧三种元素,相对分子质量为110,丁与FeCl3溶液作用显现特有的紫色,且丁分子中苯环上的一氯代物只有一种,丁的结构简式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算填空:
(1)______mol CO2中含有氧原子数跟1.806×1024个H2O分子含有的氧原子数相同。
(2)3.01×1023个H2O所含电子的物质的量为________mol。
(3)某同学将标准状况下44.8L的HCl气体溶于水,配成500mL的溶液,该HCl气体的物质的量为______,可知所配成的盐酸溶液的物质的量浓度为_____。
(4)标准状况下的甲烷和一氧化碳的混合气体8.96 L,其质量为7.60 g,则混合气体中甲烷的体积为______;一氧化碳的质量为_________。
(5)气态化合物A的化学式可以表示为OxFy,已知同温同压下10mLA受热完全分解生成15mLO2和10mL F2,则A的化学式为_____。
(6)将5 mol·L-1的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO![]() 的物质的量浓度是______ mol·L-1。
的物质的量浓度是______ mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com