
【题目】下图为一些物质之间的转化关系,其中部分反应中反应物或生成物未列全。已知A、H、I、K均为家庭厨房中的常见物质,其中A是食品调味剂,H是消毒剂的有效成分,I、K可用作食品发泡剂。B是一种有机酸盐,E、F、G均为氧化物,L是红褐色沉淀。

根据以上信息,回答下列问题:
(1)B的组成元素为_____。
(2)鉴别等物质的量浓度的I、K稀溶液的实验方法为_____。
(3)G→J的离子方程式为_____。
(4)M是含氧酸盐,反应①中H、L、D的物质的量之比为3:2:4,则M的化学式为_____。
【答案】Fe、C、O 取I、K的稀溶液,分别滴加CaCl2溶液,出现白色沉淀者为I 2FeO+H2O2+6H+=2Fe3++4H2O Na2FeO4
【解析】
A是食品调味剂,H是消毒剂的有效成分,则A为NaCl,H为NaClO,G为氧化物,加H2SO4、H2O2生成J,J加D得L,L为红褐色沉淀,则L为Fe(OH)3,D为NaOH,以此逆推可知J为Fe2(SO4)3,G为FeO,则B中含有Fe元素,C为Cl2,B为有机酸盐,则一定含有C、O两元素,E、F为氧化物,结合框图,则F为CO,E为CO2,I为Na2CO3(纯碱),K为NaHCO3(小苏打)。
(1)由以上分析可知B加热分解可生成CO、CO2、FeO,则应含有Fe、C、O三种元素,故答案为:Fe、C、O;
(2)I为Na2CO3(纯碱),K为NaHCO3(小苏打),Na2CO3与氯化钙反应生成CaCO3为白色沉淀,可加入CaCl2溶液鉴别,出现白色沉淀者为Na2CO3,故答案为:取I、K的稀溶液,分别滴加CaCl2溶液,出现白色沉淀者为I;
(3)G→J的反应为FeO生成Fe2(SO4)3的过程,H2O2具有氧化性,反应的离子方程式为2FeO+H2O2+6H+=2Fe3++4H2O,故答案为:2FeO+H2O2+6H+=2Fe3++4H2O;
(4)H、L、D分别为:NaClO、Fe(OH)3、NaOH,根据物质的量之比为3:2:4,结合生成一种含氧酸盐M,可确定M的化学式为Na2FeO4,方程式为3NaClO+2Fe(OH)3+4NaOH=2Na2FeO4+3NaCl+5H2O,故答案为:Na2FeO4。


科目:高中化学 来源: 题型:
【题目】实验室用18.4molL-1的浓硫酸来配制480mL0.2molL-1的稀硫酸。可供选用的仪器有:①胶头滴管②烧瓶③烧杯④药匙⑤量筒⑥托盘天平⑦玻璃棒
请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有___(选填序号),还缺少的仪器有(写仪器名称)___。
(2)需要用量筒量取上述浓硫酸的体积为___mL,量取浓硫酸时应选用___(选填①10mL②50mL③100mL)规格的量筒。
(3)实验中两次用到玻璃棒,其作用分别是:___、___。
(4)下列对容量瓶及其使用方法的描述中正确的是___。
A.容量瓶上标有容积、温度和浓度
B.容量瓶用蒸馏水洗净后,必须烘干
C.配制溶液时,把量好的浓硫酸小心倒入容量瓶中,加入蒸馏水到接近刻度线1~2cm处,改用胶头滴管加蒸馏水至刻度线
D.使用前要检查容量瓶是否漏水
(5)在配制过程中,下列操作可引起所配溶液浓度偏低的有___(填序号)
①未洗涤稀释浓硫酸时用过的烧杯和玻璃棒
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁是一种特殊的金属有机化合物,可用作燃料的节能消烟剂、抗爆剂等,熔点为173 ℃,在100 ℃时开始升华;沸点是249 ℃。实验室制备二茂铁的反应原理是:2KOH+FeCl2+2C5H6=Fe(C5H5)2+2KCl+2H2O,其装置如下图所示。

实验步骤为:
①在三颈烧瓶中加入25 g粉末状的KOH,并从仪器a中加入60 mL无水乙醚,充分搅拌,同时通氮气约10 min;
②再从仪器a滴入5.5 mL新蒸馏的环戊二烯(C5H6,密度为0.95 g·cm-3),搅拌;
③将6.5 g无水FeCl2与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25 mL装入仪器a中,慢慢滴入三颈烧瓶中,45 min滴完,继续搅拌45 min;
④再从仪器a加入25 mL无水乙醚搅拌;
⑤将三颈烧瓶中的液体转入仪器X中,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
(1)仪器a、X的名称分别是_____________。
(2)步骤①中通入氮气的原因是_____________(用化学方程式表示)。
(3)三颈烧瓶的适宜容积应为_________(选编号)。
①100 mL ②250 mL ③500 mL
(4)步骤⑤用盐酸洗涤的目的是_______________。
(5)步骤⑦是二茂铁粗产品的提纯,操作装置如图二所示,其操作名称为___________;该操作中棉花的作用是___________________。
(6)为了确认得到的是二茂铁,还需要进行的一项简单实验是__________。确定二茂铁的结构是下图b而不是c,其测定的谱图为_____________。
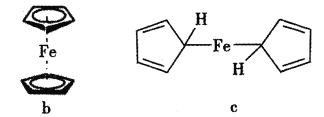
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组试利用镁铝合金废料(不含其它杂质)制备硫酸铝晶体,其实验流程如图:
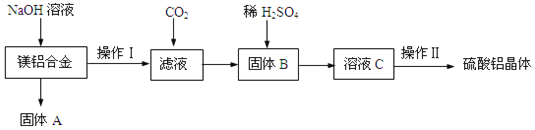
(1)在镁铝合金中加入NaOH溶液,发生反应的离子反应方程式为_____,固体B的化学式_____。
(2)操作Ⅱ包含的实验步骤有:_____、冷却结晶、过滤、洗涤、干燥。
(3)若初始时称取的镁铝合金废料的质量为7.65 g,得到固体A的质量为3.6 g,硫酸铝晶体的质量为49.95 g(假设每一步的转化率均为100%)。计算所得硫酸铝晶体的化学式为_____。( 在答题卷上写出计算过程)
(4)另取7.65 g该镁铝合金废料溶于400mL 3mol/L盐酸后,滴入3mol/LNaOH溶液,使所得沉淀中的Al(OH)3完全溶解,则滴入NaOH溶液的体积最少为_____mL(在答题卷上写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“天宫一号”使用镍氢电池供电。镍氢电池的负极材料为储氢合金(用 MH表示,氢以单原子填入合金晶格),总反应为 M+Ni(OH)2![]() MH+NiOOH,下列说法正确的是( )
MH+NiOOH,下列说法正确的是( )
A. 电池充电时氢原子被氧化
B. 电池放电时正极为NiOOH
C. 电池充电时,与电源负极相连的电极反应为MH+OH-+e-=M+H2O
D. 电池放电时,负极反应为Ni(OH)2+OH--e-=NiOOH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,调节反应物用量或浓度不会改变反应产物的是( )
A.Fe与Cl2反应
B.CO2通入石灰水
C.HNO3中加入Cu
D.AlCl3溶液中滴入NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】格氏试剂(RMgX,X=Cl、Br、I)是一种重要的有机合成中间体,酯类化合物与格氏试剂的反应是合成叔醇类化合物的重要方法,由只含一种官能团的物质A制备E的合成路线如图,回答下列问题:

已知信息如下:
①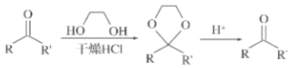
②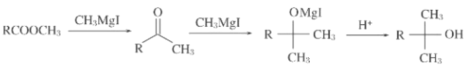
(1)A→B的反应类型为___,E的分子式为___。
(2)B中所含官能团的名称为___。
(3)C→D的化学方程式为___。
(4)M是比C多一个碳的C的同系物,同时满足下列条件的M的同分异构体有___种(不考虑立体异构)。
①含六元碳环结构,不含甲基;②能与NaHCO3溶液反应放出CO2;③能发生银镜反应。
写出其中核磁共振氢谱有七组峰,且峰面积的比是4∶4∶2∶1∶1∶1∶1的所有物质的结构简式___。
(5)将下列D→E的流程图补充完整:___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种无色溶液,可能含有以下离子中的若干种:Na+、NH4+、Cl﹣、Ba2+、HCO3﹣、SO42﹣,现取两份100mL的该溶液进行如下实验:
(1)第1份加足量NaOH溶液并加热,收集到标准状况下的气体672mL
(2)第2份加足量Ba(OH)2溶液,得沉淀6.27g,再用足量盐酸洗涤、干燥,得沉淀2.33g
根据上述实验,下列推测正确的是( )
A.该溶液中一定有Ba2+
B.c(NH4+)为0.3molL﹣1
C.100mL该溶液中含0.01 mol HCO3﹣
D.原溶液中c(Na+)和c(SO42﹣)的比值大于等于1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com