


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:

| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后得到黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| Ⅱ | 向上述溶液中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,AgCl的溶解度小于Ag2S的溶解度 |
| B、在25℃的AgNO3溶液中,AgCl的溶解度、Ksp均减小 |
| C、25℃时,在AgCl悬浊液中加入0.1mol?L-1 Na2S溶液,搅拌,生成Ag2S沉淀 |
| D、若取0.144g的AgCl放入100mL水中(忽略溶液体积的变化),则溶液中c(Cl-)=1.0×10-2 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO(g)+O2(g)=2CO2(g)△H=-566.0 kJ/mol | ||
B、C(s)+
| ||
| C、CH4(g)+2O2(g)=O2(g)+2H2O(l)△H=-890.31 kJ/mol | ||
| D、2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l)△H=-11036 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用如图装置收集以下几种气体(如图中烧瓶位置不得移动)
利用如图装置收集以下几种气体(如图中烧瓶位置不得移动)查看答案和解析>>
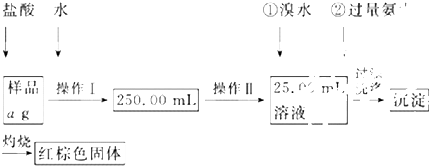
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径大小顺序为:r(C)>r(D)>r(B)>r(A) |
| B、元素C能形成两种常见的氧化物,但晶体类型相同 |
| C、X和Y对应的水溶液都显酸性 |
| D、物质CA与水反应可生产气体,CA作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在一定温度下,向1L体积固定的密闭容器中加入1molA(g),发生反应2A(g)?B(g)+C(g),B的物质的量随时间的变化如图所示. 0-2min内的平均反应速率v(A)=
(1)在一定温度下,向1L体积固定的密闭容器中加入1molA(g),发生反应2A(g)?B(g)+C(g),B的物质的量随时间的变化如图所示. 0-2min内的平均反应速率v(A)=查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com