
【题目】分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。

请回答下列问题:
(1)以下叙述中,正确的是__ 。
A.甲中锌片是负极,乙中铜片是正极 B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大 D.产生气泡的速度甲中比乙中慢
(2)乙装置中,外电路中电子移动方向 ___极流向____极(填“Zn”、“Cu”)。
(3)乙装置中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是________ 。
(4)若开始时乙装置中加入2L,lmol/LH2SO4,当电路中通过0.7mol e-,溶液中Zn2+的浓度是__mol/L。
(5)乙装置中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式: ____。
【答案】 CD Zn Cu 锌片含有杂质,其表面形成原电池 0.175mol/L Cu2++2e-=Cu
【解析】
锌比铜活泼,能与稀硫酸反应,铜为金属活动性顺序表H元素之后的金属,不能与稀硫酸反应,甲没有形成闭合回路,不能形成原电池,乙形成闭合回路,形成原电池,根据原电池的组成条件和工作原理解答该题.
(1)A.甲没有形成闭合回路,不能形成原电池,故A错误; B.铜为金属活动性顺序表H元素之后的金属,不能与稀硫酸反应,甲烧杯中铜片表面没有气泡产生,故B错误;C.两烧杯中硫酸都参加反应,氢离子浓度减小,溶液的pH均增大,故C正确; D.乙能形成原电池反应,较一般化学反应速率更大,所以产生气泡的速率甲中比乙中慢,故D正确;故选CD。(2)乙形成原电池,Zn为负极,Cu为正极,则电流方向Cu→Zn,乙装置中,外电路中电子移动方向Zn极流向Cu极。(3)乙装置中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是是由于锌片不纯,在锌片上形成原电池导致。(4)若开始时乙装置中加入2L,lmol/LH2SO4,当电路中通过0.7mol e-,溶液中Zn2+的浓度是n(Zn2+)/V=![]() = 0.175mol/L。(5)乙装置中,如果把硫酸换成硫酸铜溶液,Cu2+在正极上得电子被还原产生Cu,电极反应式为Cu2++2e-=Cu。
= 0.175mol/L。(5)乙装置中,如果把硫酸换成硫酸铜溶液,Cu2+在正极上得电子被还原产生Cu,电极反应式为Cu2++2e-=Cu。


科目:高中化学 来源: 题型:
【题目】在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH- 离子浓度分别为Amol/L与Bmol/L,则A和B关系为( )
A. A>B B. A=10-4 B C. B=10-4 A D. A=B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1;②H2(g)+![]() O2(g)===H2O(l)
O2(g)===H2O(l)
ΔH=-285.8 kJ·mol-1;
③C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ·mol-1; ④C(s)+O2(g)===CO2(g)
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1; ④C(s)+O2(g)===CO2(g)
ΔH=-393.5 kJ·mol-1。
回答下列各问题:
(1)H2的燃烧热为___________,C的燃烧热为_______________。
(2)燃烧10 g H2生成液态水,放出的热量为__________________。
(3)盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可通过间接的方法测定,则由已知条件得CO的燃烧热为____________,其燃烧热的热化学方程式为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某饱和溶液中含有三种阳离子:Ag+、Ba2+、Al3+,同时测知此溶液中pH=3,则该溶液中所含有的阴离子可以是下列中的()
A.CO32-B.SO42-C.NO3-D.Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成C、N、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了C1元素的非金属性比S强的实验研究。

回答下列问题:
(1)从以下所给物质中选出甲同学设计的实验所用到物质;试剂A为__;试剂C为___(填序号)。
①稀HN03溶液②稀盐酸③碳酸钙④Na2SiO3溶液⑤SiO2
实验开始后圆底烧瓶中观察到的现象为_____ ;该现象说明非金属性 >___(填元素符号);对应的离子方程式 _____。
(2)乙同学设计的实验:试剂B为酸性高锰酸钾溶液,则试剂A为____:试剂C为____(填序号)。
①稀盐酸 ②浓盐酸 ③NaCl溶液 ④Na2SO3溶液 ⑤Na2S溶液
实验开始后试管中观察到的现象为____,对应的离子方程式____。
(3)若反应过程中消耗0.3mol C试剂,理论上被氧化的试剂A______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如下图所示,其中A为澄清溶液,C为难溶于水的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。请回答下列问题:

(1)写出化学式:A__________C__________
(2)写出下列反应的离子方程式:
A→B:________________________________。
B→D:________________________________。
C→E:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Na2CO3固体中混有少量NaHCO3固体,除去杂质的方法是________________,化学方程式是___________________________________。
(2)NaHCO3固体中混有少量Na2CO3固体,除杂方法是________________,化学方程式是________________________________________________________。
(3)NaOH固体中混有少量Na2CO3固体,除杂方法是________________,反应的离子方程式是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-a kJ·mol-1 在5 L密闭容器中进行,10 s时,水蒸气的物质的量增加了0.60 mol。则下列说法不正确的是( )
4NO(g)+6H2O(g) ΔH=-a kJ·mol-1 在5 L密闭容器中进行,10 s时,水蒸气的物质的量增加了0.60 mol。则下列说法不正确的是( )
A. 10 s内,NH3的平均反应速率为0.008 mol·L-1·s-1
B. 该反应达到平衡时6v正(O2)=5v逆(H2O)
C. 10 s内,反应放出的热量为0.1a kJ
D. 10 s时,H2O的反应速率为0.012 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2C2O4是二元弱酸,室温下向某浓度的草酸溶液中逐滴加入KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-的组成百分率与pH的关系如图所示,下列说法正确的是
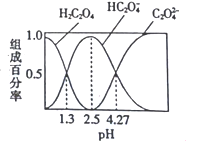
A. pH=4.27的溶液中:c(K+)+c(H+)=c(OH-)+3c(C2O42-)
B. 反应HC2O4-+H2O![]() H2C2O4+OH-的平衡常数为10-4.27
H2C2O4+OH-的平衡常数为10-4.27
C. 向溶液中加入KOH溶液将pH由1.3调至4.27的过程中水的电离程度先增大后减小
D. pH=2.5的溶液中:c(H+)+2c(H2C2O4)=c(OH-)+c(C2O42-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com