
水的电离过程为H2O
 H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14, K(35℃)=2.1×10-14。则下列叙述正确的是( )
H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14, K(35℃)=2.1×10-14。则下列叙述正确的是( )
A.c(H+)随着温度升高而降低 B.35℃时,c(H+)>c(OH-)
C.水的电离度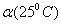 >
>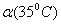 D.水的电离是吸热的
D.水的电离是吸热的
科目:高中化学 来源: 题型:
下列解释物质用途或现象的反应方程式不准确的是
A.硫酸型酸雨的形成会涉及反应:2H2SO3+O2 2H2SO4
2H2SO4
B.热的纯碱溶液可以清洗油污的原因:CO32— +2H2O
 H2CO3+2OH¯
H2CO3+2OH¯
C.盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH¯=SiO32—+H2O
D.成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ ClO-+2H+= Cl2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
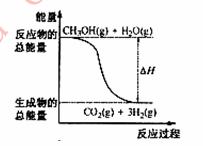
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH= + 49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
下列说法正确的是( )
A.CH3OH的燃烧热为192.9 kJ/mol
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g) ΔH > -192.9kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,反应2SO2 + O2  2SO3达到平衡时,n(SO2)∶n(O2)∶n(SO3) =
2SO3达到平衡时,n(SO2)∶n(O2)∶n(SO3) =
2∶3∶4。缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,
此时SO2的物质的量应是( )
A.0.4mol B.0.6mol C.0.8mol D.1.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在1 000 K时,已知反应Ni(s)+H2O(g) 
 NiO(s)+H2(g)的平衡常数
NiO(s)+H2(g)的平衡常数
K=0.005 9。当水蒸气和氢气的物质的量浓度相等时,此反应( )
A.已达平衡状态 B.未达平衡状态,反应正向进行
C.未达平衡状态,反应逆向进行 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
选择萃取剂将碘水中的碘萃取出,这种萃取剂应具备的性质是 ( )
A.不溶于水,且必须易与碘发生化学反应 B.不溶于水,且比水更容易使碘溶解
C.不溶于水,且必须比水密度大 D.不溶于水,且必须比水密度小
查看答案和解析>>
科目:高中化学 来源: 题型:
已知四种盐的溶解度(S)曲线如右图所示,下列说法不正确的是
A.将NaCl溶液蒸干可得NaCl固体
B.将MgCl2溶液蒸干可得MgCl2固体
C.可用MgCl2和NaClO3制备Mg(ClO3)2
D.Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯
 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com