
【题目】为了除去KCl溶液中少量的MgCl2、MgSO4杂质,可选用Ba(OH)2溶液、稀盐酸和K2CO3溶液三种试剂,按如图步骤操作:
![]()
(1)写出三种试剂的化学式:A____、B____、C____
(2)操作Ⅰ的名称是____。
(3)根据题意,回答下列问题:
①加入过量A的目的是____;
②加入适量C的目的是_____;
③加入B时的化学反应方程式_____。
【答案】Ba(OH)2 K2CO3 HCl 过滤 除去溶液中的SO42- 和Mg2+ 除去溶液中多余的OH-和CO32- Ba(OH)2 +K2CO3=BaCO3↓+2KOH
【解析】
除去KCl溶液中的少量MgCl2和MgSO4,可看成把Mg2+、SO42-沉淀而除去,因此选择所提供试剂中的Ba(OH)2可同时沉淀掉Mg2+、SO42-离子;反应生成的BaCl2和过量的Ba(OH)2可加入所选试剂中的K2CO3而除去;最后通过滴加盐酸可把过量的K2CO3及反应生成的KOH同时反应掉而生成KCl,将KCl溶液进行蒸发操作可得到KCl,以此解答该题。
(1)氢氧化钡可以将MgCl2、MgSO4中的氢氧根和硫酸根除去,除杂时,每一步所加的试剂均是过量的,过量的氢氧化钡需用碳酸钾除去,而多余的碳酸钾需用盐酸来除去,故试剂A、B、C依次是Ba(OH)2、K2CO3、HCl;
(2)①加入Ba(OH)2,可生成氢氧化镁和硫酸钡沉淀,反应的化学方程式为MgCl2+Ba(OH)2═BaCl2+Mg(OH)2↓MgSO4+Ba(OH)2═BaSO4↓+Mg(OH)2↓;
②加入过量的盐酸溶液可除去溶液中多余的OH-和CO32-;
③加入过量的K2CO3溶液可使滤液中混有的Ba(OH)2完全反应而除去,发生反应的化学方程式为Ba(OH)2 +K2CO3=BaCO3↓+2KOH。


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】某学习小组拟设计实验探究铁盐与碳酸盐反应的产物。

对实验Ⅰ、Ⅱ反应后的混合物进行过滤洗涤、低温凉干,分别得到M、N固体。
回答下列问题
(1)用pH计分别测定0.5mol·L-1 NaHCO3溶液、0.5mol·L-1Na2CO3溶液,得pH依次为a、b。预测a___________b(填“>”“<”或“=”)
(2)为了定性确认M、N成分,进行实验:

X的化学式为___________(填化学式)
(3)为了进一步探究M(无结晶水的纯净物)的组成进行如下实验:

①点燃酒精灯前,先通入N2,其目的是____________。加热一段时间后,装置A中棕色粉末变红色,装置B中白色粉末变蓝色;装置C中产生白色沉淀。当装置A中M完全反应时停止加热,继续通入N2。
②停止加热之前,___________先拆去B、C之间导管(填“要”或“不要”)。
③对装置C中混合物进行过滤、洗涤、干燥、称重,白色固体质量为19.7g。装置A中残留红色粉末的质量为8.0g,则M的化学式为___________。
(4)FeCl3溶液和Na2CO3溶液反应的离子方程式为________。
(5)铁盐与碳酸盐溶液反应产物不同可能与___________、浓度、水解产物CO2有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应和反应类型不相符的是
A. 苯与浓硝酸、浓硫酸混合加热制取硝基苯(取代反应)
B. 在一定条件下,苯与氯气生成六氯环己烷(加成反应)
C. 由乙炔(![]() )制取氯乙烯(CH2=CHCl) (氧化反应)
)制取氯乙烯(CH2=CHCl) (氧化反应)
D. 在催化剂的作用下由乙烯制取氯乙烷(加成反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图实验装置判断,下列说法正确的是

A.该装置能将电能转化为化学能
B.活性炭为正极,其电极反应式为: 2H++2e-=H2↑
C.电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔
D.装置内总反应方程式为:4Al+3O2 +6H2O = 4Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下, 0.1 mol/L的某二元酸 H2A 溶液中,可能存在的所有含 A 粒子的物质的量分数随pH 变化的关系如图所示。下列说法正确的是

A. H2A 的电离方程式:H2A![]() H+ + HA-
H+ + HA-
B. pH = 5 时,在NaHA和Na2A的混合溶液中: c(HA-) : c(A2-)= 1 : 100
C. 等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-)
D. NaHA溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用物质的量浓度为0.100 0 mol·L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:

(1)用标准NaOH溶液滴定时,应将标准NaOH溶液注入_______(填“甲”或“乙”)中。
(2)某学生的操作步骤如下:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液;
D.取标准NaOH溶液注入碱式滴定管至“0”刻度以上 2~3 mL;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是____→___→___→___→A→___(用字母序号填写)。判断到达滴定终点的实验现象是_____________________________________
(3)右上图是碱式滴定管中液面在滴定前后的读数, c(HCl)=_______ mol·L-1。
(4)由于错误操作,使得上述所测盐酸溶液的浓度偏高的是________(填字母)。
A.中和滴定达终点时俯视滴定管内液面读数
B.酸式滴定管用蒸馏水洗净后立即取用25.00 mL待测酸溶液注入锥形瓶进行滴定
C.碱式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.用酸式滴定管量取待测盐酸时,取液前有气泡,取液后无气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的如上图所示.由图可得出的正确结论是( )
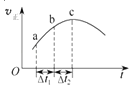
A.反应物的总能量低于生成物的总能量
B.反应物浓度:a点小于b点
C.△t1=△t2时,SO2的转化率:a~b段小于b~c段
D.反应在c点达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)==NH4HSO3(aq) △H1=akJ·mol-1;
②NH3·H2O(aq)+NH4HSO3(aq)==(NH4)2SO3(ag)+H2O(l) △H2=bkJ·mol-1;
③2(NH4)2SO3(aq)+O2(g)==2(NH4)2SO4(aq) △H3=ckJ·mol-1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g)==2(NH4)2SO4(aq)+2H2O(1)的△H=___________kJ·mol-1。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)===2CaSO4(s)+2CO2(g)
△H=-681.8kJ·mol-1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
0 | 10 | 20 | 30 | 40 | 50 | |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(O2)___________mol·L-1·min-1;当升高温度,该反应的平衡常数K___________(填“增大”“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是___________(填字母)。
A加入一定量的粉状碳酸钙 B通入一定量的O2
C适当缩小容器的体积 D加入合适的催化剂
(3) NOx的排放主要来自于汽车尾气,人利用反应
C(s)+2NO(g)![]() N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:

由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为____________________;在1100K时,CO2的体积分数为___________。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=___________[已知:气体分压(P分)=气体总压(Pa)×体积分数]。
(5)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数___________(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1 molCO和1 molNO,在一定温度下达到平衡时,CO的转化率为40%,则![]() =___________。
=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的由Cu和Cu2O组成的混合粉末加入到125 mL 2.6 mol·L-1的稀硝酸中,固体完全溶解,得蓝色溶液X并收集到V mL(标准状况)的纯净无色气体Y。下列结论错误的是
A. 纯净无色气体Y与0.75VmL(标准状况)O2混合后通入水中,气体可被完全吸收
B. 若固体与硝酸恰好完全反应,当V=1680时,Cu2O与Cu的物质的量之比为8∶1
C. 原混合粉末的总质量可能为9.8 g
D. 向溶液中加入NaOH溶液,使Cu2+恰好完全沉淀,消耗NaOH的物质的量为(0.325-V/22400)mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com