
【题目】某学习小组拟设计实验探究铁盐与碳酸盐反应的产物。

对实验Ⅰ、Ⅱ反应后的混合物进行过滤洗涤、低温凉干,分别得到M、N固体。
回答下列问题
(1)用pH计分别测定0.5mol·L-1 NaHCO3溶液、0.5mol·L-1Na2CO3溶液,得pH依次为a、b。预测a___________b(填“>”“<”或“=”)
(2)为了定性确认M、N成分,进行实验:

X的化学式为___________(填化学式)
(3)为了进一步探究M(无结晶水的纯净物)的组成进行如下实验:

①点燃酒精灯前,先通入N2,其目的是____________。加热一段时间后,装置A中棕色粉末变红色,装置B中白色粉末变蓝色;装置C中产生白色沉淀。当装置A中M完全反应时停止加热,继续通入N2。
②停止加热之前,___________先拆去B、C之间导管(填“要”或“不要”)。
③对装置C中混合物进行过滤、洗涤、干燥、称重,白色固体质量为19.7g。装置A中残留红色粉末的质量为8.0g,则M的化学式为___________。
(4)FeCl3溶液和Na2CO3溶液反应的离子方程式为________。
(5)铁盐与碳酸盐溶液反应产物不同可能与___________、浓度、水解产物CO2有关。
【答案】< Fe(OH)3 KSCN或 NH4SCN 排尽装置内的空气和水蒸气 不要 Fe(OH)CO3 Fe3++2CO32-+H2O=Fe(OH)CO3↓+HCO3- 碱性强弱
【解析】
(1)Na2CO3水解能力强,碱性强;
(2)KSCN或 NH4SCN是检验铁离子的特效试剂,现象是溶液呈红色,N溶于酸,无气泡,加KSCN或 NH4SCN后呈红色,说明N是Fe(OH)3 ;
(3)①实验中有水蒸气和二氧化碳产生,要排尽装置内的空气和水蒸气;
②停止加热之前,不要先拆去B、C之间导管,空气中的水分会进入B中。
③白色固体质量为19.7g,可算出n(CO2),A中残留红色粉末的质量为8.0g,可算出n(Fe)。
(4)FeCl3溶液和Na2CO3反应生成Fe(OH)CO3;
(5)铁盐与碳酸盐溶液反应产物不同可能与碱性强弱、浓度、水解产物CO2有关,碱性强,产物中氢氧根的含量增大。
(1)Na2CO3水解能力强,碱性强,用pH计分别测定0.5mol·L-1 NaHCO3溶液、0.5mol·L-1Na2CO3溶液,得pH为a<b;
(2)KSCN或 NH4SCN是检验铁离子的特效试剂,现象是溶液呈红色,N溶于酸,无气泡,加KSCN或 NH4SCN后呈红色,说明N是Fe(OH)3 ;
(3)①加热一段时间后,装置A中棕色粉末变红色,装置B中白色粉末变蓝色;装置C中产生白色沉淀。说明有水蒸气和二氧化碳产生,故①点燃酒精灯前,先通入N2,其目的是排尽装置内的空气和水蒸气。
②停止加热之前,不要先拆去B、C之间导管,空气中的水分会进入B中,影响实验结果。
③白色固体质量为19.7g,n(CO2)=n(BaCO3)=19.7g/197g·mol-1=0.1mol,A中残留红色粉末的质量为8.0g,n(Fe)=8.0g/160g·mol-1×2=0.1mol,故M化学式为Fe(OH)CO3。
(4)FeCl3溶液和Na2CO3反应生成Fe(OH)CO3,溶液反应的离子方程式为Fe3++2CO32-+H2O=Fe(OH)CO3↓+HCO3-。
(5)铁盐与碳酸盐溶液反应产物不同可能与碱性强弱、浓度、水解产物CO2有关,碱性强,产物中氢氧根的含量增大。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】以铜银合金(含少量铁)废料为原料回收银和铜的工艺流程如下:

下列说法正确的是
A. 粗铜溶于过量稀硝酸,过滤、低温干燥得纯铜
B. 电解时用粗银作阴极,硝酸银溶液为电解质溶液
C. 用稀硫酸处理渣料时主要发生了氧化还原反应
D. 从滤液B中可以提取绿矾(FeSO4·7H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组设计实验探究铜的常见化学性质,过程设计如下所示
(提出猜想)
问题1:在周期表中,铜与铝的位置很靠近,铜不如铝活泼,氢氧化铝具有两性。那么,氢氧化铜也具有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价铁的稳定性。那么,正一价铜的稳定性也小于正二价铜的稳定性吗?
问题3:氧化铜具有氧化性,能被H2、CO还原。那么,氧化铜也能被氮的某种气态氢化物还原吗?
(实验探究)
I.解决问题1
(1)需用到的药品除1mol L-1 CuSO4溶液、稀硫酸外,还需_________(填试剂的化学式)溶液。
(2)用胆矾晶体配制1molL-1 CuSO4溶液250mL,选用的仪器除烧杯、托盘天平、药匙、玻璃棒、胶头滴管、量简外,还有________(填仪器名称)。
(3)为达到实验目的,你认为应进行哪些相关实验?
实验内容和步骤:①_________;②_______________。
Ⅱ.解决问题2
取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃时得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁浄试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验现象回答冋题:
(1)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:_____________。
(2)从实验Ⅱ可得出的结论是_______________________。
Ⅲ.解决问题3
设计如下装置(夹持装置未画出):

当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水CuSO4变成了蓝色,生成物中还有一种无污染的单质气体Y;将X通入灼热的CuO燃烧管完全反应后,消耗0.01molX,测得B装置增重0.36g,并收集到0.28g单质气体Y。
(1)X气体的摩尔质量是_________________。
(2)C装置中发生反应的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖的结构简式为CH2OH-CHOH-CHOH-CHOH-CHOH-CHO,其对应的性质中不正确的是( )
A.与钠反应放出氢气B.可与乙酸发生酯化反应
C.能发生银镜反应D.可与小苏打溶液反应,产生气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酯W是一种疗效明显的血管扩张剂,一种合成流程如下:
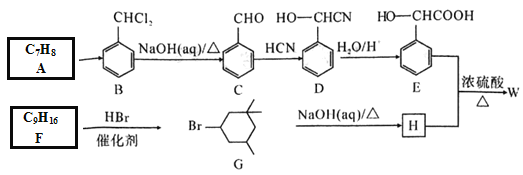
回答下列问题
(1)E中含碳官能团的名称是_______;C的名称是_____。
(2)A→B反应条件和试剂是___________;C→D的反应类型是___________。
(3)写出W的结构简式:___________。能测定H分子中所含化学键和官能团种类的仪器名称是____________。
(4)写出F→G的化学方程式:__________。
(5)R是E的同分异构体R同时具备下列条件的结构有______种
①遇氯化铁溶液发生显色反应; ②能发生水解反应和银镜反应,其中,在核磁共振氢谱上有5组峰且峰的面积比为1:1:2:2:2的结构简式为___________。
(6)以乙醛为原料合成环酯 ,设计合成路线(其他试剂自选):______________。
,设计合成路线(其他试剂自选):______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.放热反应在常温下一定很容易发生
C.化学反应中的能量变化主要是由化学键变化引起的
D.化学反应中能量变化的大小与反应物的质量多少无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在容积为 10L 的密闭容器中,1molX 和 1molY 进行如下反应:2X(g)+Y(g)![]() Z(g) 经 60s 达到平衡,生成 0.3molZ,下列说法正确的是
Z(g) 经 60s 达到平衡,生成 0.3molZ,下列说法正确的是
A. 以 X 浓度变化表示的反应速率为 0.001mol/(L·s)
B. 将容器容积变为 20L,Z 的平衡浓度为原来的 1/2
C. 若增大压强,则正反应速率增大,逆反应速率减小
D. 若升高温度,X 的体积分数增大,则该反应的ΔH >0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业的原理改进方法如图分两个阶段进行,下列说法中错误的是( )

A. 在阶段I中,电源a为正极、b为负极
B. 阶段Ⅱ阴极反应:Na0.44-xMnO2+xe-+xNa+=Na0.44MnO2
C. 比传统氯碱工业减少了阳离子交换膜,避免氢气和氯气混合,便于NaOH提纯
D. 阶段Ⅰ,Ⅱ的反应不能都在饱和食盐水的条件下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去KCl溶液中少量的MgCl2、MgSO4杂质,可选用Ba(OH)2溶液、稀盐酸和K2CO3溶液三种试剂,按如图步骤操作:
![]()
(1)写出三种试剂的化学式:A____、B____、C____
(2)操作Ⅰ的名称是____。
(3)根据题意,回答下列问题:
①加入过量A的目的是____;
②加入适量C的目的是_____;
③加入B时的化学反应方程式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com