
【题目】根据所学物质结构知识,请你回答下列问题:
(1)已知氮元素是植物生长所需的元素,常见氮肥有铵盐(![]() )、尿素
)、尿素![]() 等
等
①尿素分子中四种元素的电负性由大到小顺序是_______________。
②![]() 中H—N—H键角比NH3中H—N—H键角大,原因为_______________。
中H—N—H键角比NH3中H—N—H键角大,原因为_______________。
(2)[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:
4HCHO+[Zn(CN)4]2-+4H++4H2O===[Zn(H2O)4]2++4HOCH2CN
①Zn2+基态核外电子排布式为___________________。
②与H2O分子互为等电子体的阴离子为________。
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为_____________________。
(3)根据对角线规则,铍(Be)与铝性质相似。
①以下对铍及其化合物的推断肯定不正确的是_______________(选填序号)。
a.常温下铍会在浓硫酸中钝化 b.氯化铍是共价化合物
c.氧化铍坚硬难熔 d.氢氧化铍是强碱
②写出BeCl2溶液和Na2BeO2溶液混合后反应的离子方程式_______________。
(4)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为________,其中Fe的配位数为_____________。
【答案】O>N>C>H NH3分子中存在一对孤电子对,孤电子对对成键电子对的排斥力大于成键电子对对成键电子对的排斥力(其他合理也行)。 1s22s22p63s23p63d10(或[Ar]3d10) NH2- 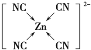 d Be2++BeO22-+2H2O==2Be(OH)2↓
d Be2++BeO22-+2H2O==2Be(OH)2↓ ![]() 4
4
【解析】
(1)①由尿素分子结构式判断四种元素的电负性大小,属基础题;
②NH3中N原子上有一对孤对电子,NH3中孤电子对与成键电子对排斥力较大,使键角变小;
(2)①Zn 的原子序数为30,故Zn2+基态核外电子排布式为1s22s22p63s23p63d10;
②等电子体是指化学通式相同且价电子总数相同的分子或离子,等电子体具有相同的空间构型和化学键类型;
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键, [Zn(CN)4]2-的结构可用示意图表示为 ;
;
(3)根据对角线规则,铍(Be)与铝性质相似。可据此解答问题;
(4)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为![]() ,本题考查的是配位键的形成。
,本题考查的是配位键的形成。
(1)①由尿素分子结构式![]() 可知,四种元素为H、C、N、O,故四种元素的电负性由大到小顺序是O>N>C>H,答案为:O>N>C>H;
可知,四种元素为H、C、N、O,故四种元素的电负性由大到小顺序是O>N>C>H,答案为:O>N>C>H;
②![]() 中N原子没有孤对电子,而NH3中N原子上有一对孤对电子,NH3中孤电子对与成键电子对排斥力较大,使键角变小,即
中N原子没有孤对电子,而NH3中N原子上有一对孤对电子,NH3中孤电子对与成键电子对排斥力较大,使键角变小,即![]() 中H—N—H键角比NH3中H—N—H键角大。故答案为:NH3分子中存在一对孤电子对,孤电子对对成键电子对的排斥力大于成键电子对对成键电子对的排斥力;
中H—N—H键角比NH3中H—N—H键角大。故答案为:NH3分子中存在一对孤电子对,孤电子对对成键电子对的排斥力大于成键电子对对成键电子对的排斥力;
(2)①Zn 的原子序数为30,Zn基态核外电子排布式为1s22s22p63s23p63d104s2,故Zn2+基态核外电子排布式为1s22s22p63s23p63d10;故答案为:1s22s22p63s23p63d10 ;
②等电子体是指化学通式相同且价电子总数相同的分子或离子,等电子体具有相同的空间构型和化学键类型,与H2O分子互为等电子体的阴离子为NH2-,故答案为:NH2-;
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。Zn2+提供空轨道,CN-中C提供孤对电子,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为 ,故答案为:
,故答案为: ;
;
(3)根据对角线规则,铍(Be)与铝性质相似。
①a.常温下铝会在浓硫酸中钝化,故常温下铍也会在浓硫酸中钝化,a正确;
b.氯化铝是共价化合物,故氯化铍也是共价化合物,b正确;
c.氧化铝熔点高,坚硬难熔,故氧化铍坚硬难熔,c正确;
d.氢氧化铝是弱碱,故氢氧化铍是弱碱,d错误;
故本题答案为d;
②BeCl2溶液和Na2BeO2溶液混合后反应后生成Be(OH)2沉淀,其反应的离子方程式为:Be2++BeO22-+2H2O==2Be(OH)2↓,故答案为:Be2++BeO22-+2H2O==2Be(OH)2↓; (4)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为![]() ,其中Cl提供孤对电子,Fe提供空轨道形成配位键;由结构式可知Fe的配位数为4,故答案为:
,其中Cl提供孤对电子,Fe提供空轨道形成配位键;由结构式可知Fe的配位数为4,故答案为:![]() ,4;
,4;


科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组设计实验验证NH3能还原CuO,并对还原产物进行探究。请回答下列问题:
Ⅰ.验证NH3能还原CuO

(1)试剂X为___________________________。
(2)请将提供的装置按合理顺序连接。g→_______________________。
(3)装置B的作用是_______________________。
(4)证明NH3能还原CuO的实验现象是_______________________。
II.探充还原产物的成分
【查阅资料】Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)=Cu+CuSO4+H2O。
【实验探究】
实验操作 | 实验现象 | 实验结论 |
取10.4g红色固体于烧杯中,加入足量稀硫酸,充分搅拌,静置 | 若无现象 | ①证明红色固体为_________。 |
若溶液变蓝 | ②证明红色固体肯定含有______,可能含有__________。 | |
取上述反应后的混合物过滤、洗涤、干燥、称重,得固体6.4g | ③经计算,红色固体的成分及其物质的量__________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,生成深蓝色的配合离子![]()
C.![]() 比
比![]() 中的配位键稳定
中的配位键稳定
D.用硝酸铜溶液代替硫酸铜溶液进行实验,不能观察到同样的现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两化学活动小组对中学化学教材中“氨的催化氧化”进行了实验探究。
(1)甲小组设计了如下图所示的实验装置(固定装置已略去)。

①若装置A中使用的药品是NH4HCO3固体,则A需要的仪器有试管、导管、橡胶塞和_______(填选项序号)。
a.锥形瓶 b.酒精灯 c.烧瓶 d.蒸发皿
②装置B的作用是___________________;装置D的作用是___________________。
③装置C中发生反应的化学方程式为________________________________。
④若A、B中药品足量,则可以观察到装置F中的实验现象是_____________________________。
⑤该装置存在的主要缺陷是___________________________________________________。
(2)乙小组认为可将甲小组的装置中A、B部分换成如图所示装置(其余部分相同)进行实验。

①烧瓶中加入的是过氧化钠固体,则分液漏斗中加入的最佳试剂是___________,U型管中加入的试剂是___________。
②此装置能产生大量氨气的原因是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A是分子式为![]() 的五元环状化合物,核磁共振氢谱有四组峰,且其峰面积之比为
的五元环状化合物,核磁共振氢谱有四组峰,且其峰面积之比为![]() ,有如图所示的转化:
,有如图所示的转化:

已知:
![]() 含羰基的化合物均能与格氏试剂发生如下反应:
含羰基的化合物均能与格氏试剂发生如下反应:![]()
![]()
![]()
![]() 两个羟基连在同一碳原子上极不稳定,易脱水:
两个羟基连在同一碳原子上极不稳定,易脱水: →
→![]() +H2O
+H2O
根据以上信息,回答下列问题:
![]() 写出化合物D中官能团的名称________。
写出化合物D中官能团的名称________。
![]() 写出化合物B、F的结构简式________、________。
写出化合物B、F的结构简式________、________。
![]() 的反应类型是________。
的反应类型是________。
![]() 写出D与
写出D与![]() 反应的化学方程式________________
反应的化学方程式________________![]() 写出
写出![]() 的化学方程式_______________________。
的化学方程式_______________________。
![]() 的属于芳香族化合物的同分异构体有________种,写出符合下列条件的A的一种同分异构体W的结构简式________。
的属于芳香族化合物的同分异构体有________种,写出符合下列条件的A的一种同分异构体W的结构简式________。![]() 不考虑立体异构
不考虑立体异构![]()
![]() 含有两个取代基
含有两个取代基 ![]() 苯环上的一氯代物只有两种
苯环上的一氯代物只有两种 ![]() 能与足量金属钠反应生成
能与足量金属钠反应生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
请回答下列问题:
(1)写出下列元素的名称:A______, B_______, C________,D__________
(2)写出C元素在周期表的位置_________,E2+价电子的轨道表示式________________,B元素能量最高的电子为_____轨道上的电子,其轨道呈_______形.
(3)按原子轨道的重叠方式,1molA与C形成的最高价化合物中σ键有______个,π键有______个。
(4)B、C、D的简单离子的半径由大到小的顺序为_____________(用离子符号表示)。
(5)写出C的核外有18个电子的氢化物的电子式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.将5.85gNaCl晶体溶入100mL水中,制得0.1mol/LNaCl溶液
B.将1体积cmol/L硫酸溶液用水稀释为5体积,得到0.2cmol/L硫酸溶液
C.将25g无水CuSO4溶于水制成100mL溶液,其浓度为1mol/L
D.将wga%NaCl溶液蒸发掉![]() g水,一定得到2a%NaCl溶液
g水,一定得到2a%NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性
Ⅰ.实验室制备FeBr2
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁。
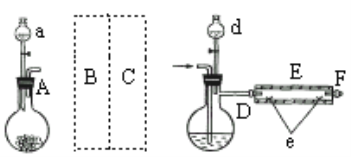
请回答:
(1)若在A中盛固体CaCO3,a中盛6mol/L盐酸,B处是装有饱和NaHCO3溶液的洗气瓶为使导入D中的CO2为干燥纯净的气体,则图中C处的装置和其中的试剂应是:________,为防止污染空气,实验时应在F处连接盛________的尾气吸收装置。
(2)反应过程中要不断通入CO2,其主要作用有两个:①是利用CO2把反应器中空气赶尽;②是________.
Ⅱ.探究FeBr2的还原性
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是________。
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
设计实验证明假设2是正确的_______________________________
(3)实验证明:还原性Fe2+>Br-请用一个离子方程式来证明:_____________;
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普伐他汀是一种调节血脂的药物,其结构如图所示。下列关于普伐他汀的性质描述正确的是
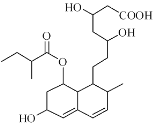
A.能发生加成、取代、消去反应
B.不能使酸性KMnO4溶液褪色
C.能与FeCl3溶液发生显色反应
D.1mol该物质最多可与3molNaOH反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com