
 在试管A中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL 浓硫酸和2mL 乙酸,按如图所示连接好装置进行实验,以制取乙酸乙酯.
在试管A中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL 浓硫酸和2mL 乙酸,按如图所示连接好装置进行实验,以制取乙酸乙酯.| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
| A、3.6 mol |
| B、3.2 mol |
| C、2.4 mol |
| D、1.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
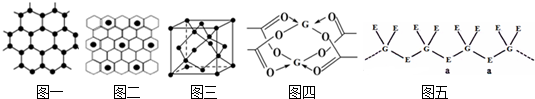
 ”表示),原子分布如图二所示,该物质的化学式为
”表示),原子分布如图二所示,该物质的化学式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 )该反应的原子利用率为100%,反应的化学方程式为
)该反应的原子利用率为100%,反应的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如图
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如图
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com