
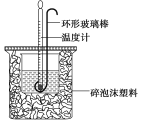
【题目】实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.3 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 20.5 | 20.6 | 24.9 |
(1)碎泡沫塑料的作用是____________________环形玻璃搅拌棒可不可以用铜丝搅拌棒代替,为什么
(2)该实验测得的中和热数值为 kJ·mol-1, (盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算)。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热的数值 (“偏大”、“偏小”或“不变”)
【答案】(1)保温隔热,减少热量损失;不可以;铜的导热性好,易损失热量产生误差
(2)56.8
(3)偏小
【解析】
试题分析:(1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:保温、隔热,减少实验过程中的热量损失;不能用环形铜丝搅拌棒代替环形玻璃搅拌棒,因为铜丝搅拌棒是热的良导体,易损失热量产生误差。
故答案为:保温隔热,减少热量损失;不可以;铜的导热性好,易损失热量产生误差;
(2)第1次实验盐酸和NaOH溶液起始平均温度为20.3℃,反应后温度为:23.7℃,反应前后温度差为:3.4℃;
第2次实验盐酸和NaOH溶液起始平均温度为20.4℃,反应前后温度差为:3.4℃;
第3次实验盐酸和NaOH溶液起始平均温度为20.55℃,反应前后温度差为:4.35℃;
50mL的0.50mol/L盐酸与50mL的0.55mol/L氢氧化钠溶液的质量和为m=100mL×1g/cm3=100g,c=4.18J/(g℃),代入公式Q=cm△T得生成0.05mol的水放出热量
Q=4.18J/(g℃)×100g×![]() =1.414kJ,即生成0.025mol的水放出热量为:1.414kJ,所以生成1mol的水放出热量为:1.414kJ÷0.02=56.8kJ。即该实验测得的中和热△H=-56.8kJ/mol,
=1.414kJ,即生成0.025mol的水放出热量为:1.414kJ,所以生成1mol的水放出热量为:1.414kJ÷0.02=56.8kJ。即该实验测得的中和热△H=-56.8kJ/mol,
故答案为:-56.8;
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,由于氨水属于弱电解质,电离过程中会吸收部分热量,所以测得中和热的数值偏小。
故答案为:偏小。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】随着卤素的原子半径的增大,下列递变规律正确的是( )
A. 单质的熔点逐渐降低 B. 卤素离子还原性逐渐增强
C. 气态氢化物稳定性逐渐增强 D. 单质氧化性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和铁是日常生活中用途广泛的金属。
(1)常温下,可用铝和铁质容器盛装浓硫酸的原因是____ 。
(2)但是铝制容器不能装NaOH等碱溶液,原因是(用离子方程式表示) ;
(3)工业上冶炼铝,反应的化学方程式为_
(4)某实验小组利用右图装置验证铁与水蒸气的反应。
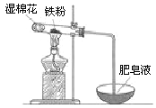
①湿棉花的作用是 ,试管中反应的化学方程式是 _。
②实验结束后,取出少量反应后的固体于试管中,加入过量盐酸,固体完全溶解,所得溶液中存在的阳离子是___________(填序号)。
a.一定有Fe2+、H+和Fe3+ b.一定有Fe2+、H+,可能有Fe3+
c.一定有Fe2+、Fe3+,可能有 H+ d.一定有Fe3+、H+,可能有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是( )
A. 利用金属钠或者金属钾
B. 利用质谱法
C. 利用红外光谱法
D. 利用核磁共振氢谱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二乙酸-1,4-环己二醇酯可以通过下列路线合成。请回答下列问题:

(1)反应①—④中,属于取代反应的有 (填序号);
反应⑥—⑧中,属于加成反应的有 (填序号)。
(2)写出下列物质的结构简式:B ,C 。
(3)写出下列反应的方程式
反应②: ;
反应⑦:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)有机物A的结构简式为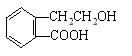 ,它可通过不同化学反应分别制得B、C、D和E四种物质
,它可通过不同化学反应分别制得B、C、D和E四种物质
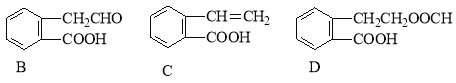
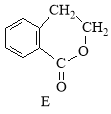
请回答下列问题:
(1)化合物E的分子式是_______________。
(2)在A~E五种物质中,互为同分异构体的是 (填字母)。
(3)写出下列反应的化学方程式
A→B: ;
A→D: 。
(4) 化合物D不能发生的反应是 (填字母)。
A.加成反应 B.酯化反应 C.消去反应 D.水解反应 E.银镜反应
(5) C通过加聚反应能形成高聚物,该高聚物的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上综合利用铝土矿的部分工艺流程如下。
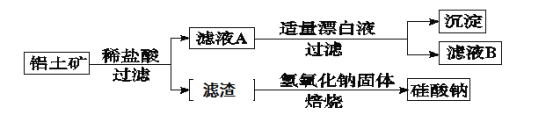
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
该过程中涉及某氧化还原反应如下,请完成:
□Fe2++□ClO-+ = □Fe(OH)3↓+□C1-+ 。
(2)检验滤液B中是否还含有Fe2+的方法为: 。
(3)将滤液B中的铝元素以沉淀形式析出,选用的最好试剂为 (填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
(4)由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、 (填操作名称)、洗涤。
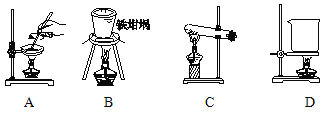
(5)滤渣的主要成分是 (填化学式),其与NaOH固体焙烧制备硅酸钠,可采用的装置为 (填代号),该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.乙酸和乙酸乙酯可用Na2CO3溶液加以区别
B.戊烷(C5H12)有两种同分异构体
C.乙烯、聚氯乙烯和苯分子中均含有碳碳双键
D.糖类、油脂和蛋白质均可发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“飘尘”是物质燃烧时产生的粒状漂浮物,颗粒很小(直径小于10-7m),不易沉降(可漂浮数小时甚至数年),它与空气中的SO2、O2接触时,SO2会转化为SO3,使空气酸度增加。飘尘所起的主要作用与下列变化中硫酸的作用相同的是( )
A. 氯气除杂过程中通入浓硫酸中 B. 浓硫酸与木炭共热
C. 乙酸乙酯与稀硫酸共热 D. 浓硫酸可以用铝槽车运输
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com