
【题目】已知A(g)+2B(g)![]() C(g)+4D(g) ΔH=+Q kJ·mol-1(Q>0)。某温度压强下,在密闭容器进行上述反应,下列叙述正确的是( )
C(g)+4D(g) ΔH=+Q kJ·mol-1(Q>0)。某温度压强下,在密闭容器进行上述反应,下列叙述正确的是( )
A.反应过程中,若压缩体积增大压强能提高A的转化率
B.若反应开始时A为1 mol,则达到平衡时吸收的热量为Q kJ
C.反应至4 min时,若D浓度为0.12 mol·L-1,则B的反应速率为0.03 mol·L-1·min-1
D.反应吸收0.025Q kJ热量时,生成的D的物质的量为0.1 mol
【答案】D
【解析】
A.该反应的正反应是气体体积增大的反应,在反应过程中,若压缩体积增大压强,化学平衡向气体体积减小的逆反应方向移动,使A的转化率减小,A错误;
B.反应为可逆反应,反应物不能完全转化为生成物,所以若反应开始时A为1 mol,则达到平衡时吸收的热量小于Q kJ,B错误;
C.反应至4 min时,若D浓度为0.12 mol·L-1,反应消耗B的浓度为0.06 mol·L-1,用B的浓度变化表示反应速率为v(B)=![]() =0.015 mol·L-1·min-1,C错误;
=0.015 mol·L-1·min-1,C错误;
D.根据方程式可知:每反应生成4 mol D,吸收Q kJ的热量,若反应吸收0.025Q kJ热量时,生成的D的物质的量为![]() ×4 mol=0.1 mol,D正确;
×4 mol=0.1 mol,D正确;
故合理选项是D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 将过量的氨水加入到CuSO4溶液中,最终得到蓝色沉淀
B. 由于氢键的作用,H2O的稳定性强于H2S
C. 在核电荷数为26的元素原子核外价电子排布图为![]()
D. 核外电子数为奇数的基态原子,其原子轨道中可能不含“未成对电子”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在抗击新冠肺炎的过程中,科研人员研究了法匹拉韦、利巴韦林、氯硝柳胺等药物的疗效,三种药物主要成分的结构简式如下。下列说法不正确的是
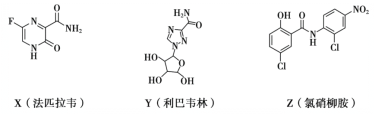
A.X的分子式为C5H4O2N3F
B.Z中含有6种官能团
C.Y和Z都有羟基,但性质不完全相同
D.X和Z都能发生加成反应和水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丁基甲酸是有机合成中一种有用的中间体。某研究小组以丙烯醛为原料,设计了如下路线合成环丁基甲酸(部分反应条件、产物已省略)。
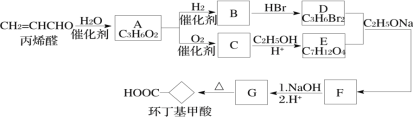
已知:
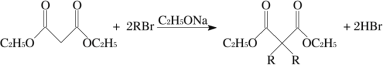
(1)
(2)![]()
请回答下列问题:
(1)由丙烯醛生成化合物A的反应类型为____________。
(2)化合物C的结构简式是________________________。
(3)下列说法中正确的是___________(填字母代号)。
A.丙烯醛可以发生银镜反应 B.化合物B和C能形成高聚物
C.化合物G的化学式为C6H8O4 D.1mol化合物B与足量金属钠反应能生成1mol氢气
(4)写出D+E→F的化学方程式:__________________________________________。
(5)符合下列条件的G的同分异构体有____________种,写出其中在1H-NMR谱上显示两组峰且面积比为3∶1的结构简式:______________________。
①能使Br2/CCl4溶液褪色;②1mol G与1mol Na2CO3反应可以生成1mol CO2
(6)以1,3-丁二烯和化合物E为原料可制备![]() ,请选用必要的试剂设计合成路线____________________。
,请选用必要的试剂设计合成路线____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离过程为H2O![]() H++OH-,在25℃和35℃时其离子积分别为1.0×10-14、2.1×10-14。下列说法正确的是( )
H++OH-,在25℃和35℃时其离子积分别为1.0×10-14、2.1×10-14。下列说法正确的是( )
A.水的电离过程是吸热过程
B.c(H+)随着温度升高而降低
C.水的电离度α(35℃)>α(25℃)
D.在25℃时,纯水中c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L庚烷的分子数约为NA
B.1 L0.1mol/L的Na2S溶液中S2-和HS-的总数为0.1NA
C.4.0 g![]() 与D2O的混合物中所含中子数为2NA
与D2O的混合物中所含中子数为2NA
D.50 mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯胺(NCl3)是一种饮用水二级消毒剂,可由以下反应制备:
Ⅰ.![]()
![]()
回答下列问题:
(1)已知:Ⅱ.![]()
![]()
Ⅲ.![]()
![]()
则![]() =________(用含
=________(用含![]() 和
和![]() 的代数式表示)。
的代数式表示)。
(2)向容积均为2L的甲乙两个恒温密闭容器中分别加入4mol NH3和4mol Cl2,发生反应Ⅰ,测得两容器中n(Cl2)随反应时间的变化情况如下表所示:
时间/min | 0 | 40 | 80 | 120 | 160 |
容器甲(T1) | 4.0 | 3.0 | 2.2 | 1.6 | 1.6 |
容器乙(T2) | 4.0 | 2.9 | 2.0 | 2.0 | 2.0 |
①0~80min内,容器甲中v(NH3)=________________。
②反应Ⅰ的![]() ________0(填“>”或“<”),其原因为________________________。
________0(填“>”或“<”),其原因为________________________。
③关于容器乙,下列说法正确的是________(填选项字母)。
A.容器内![]() ,说明反应达到平衡状态
,说明反应达到平衡状态
B.反应进行到70min时,v正一定大于v逆
C.容器内气体平均相对分子质量在增大,说明平衡在正向移动
D.达平衡后,加入一定量NCl3(l),平衡逆向移动
E.达平衡后,按原投料比再充入一定量反应物,平衡后NH3的转化率增大
④温度为T1时HCl(g)的平衡体积分数=________,该温度下,若改为初始体积为2L的恒压容器,平衡时容器中n(Cl2)________(填“>”、“=”或“<”)1.6mol。
⑤温度为T2时,该反应的平衡常数K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一个固定体积的密闭容器充入 2mol A 和 1mol B,发生如下反应:2A(g)+B(g) 3C(g)+D(g),2 分钟后,反应达到平衡,C 的浓度为 1.2mol/L。
(1)用 A 表示 2 分钟内平均反应速率为_____,A 在第 1 分钟平均速率_______第 2分钟平均速率(填“<”、“>”、“=”)。
(2)容器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为_____(填“吸热”或“放热”)反应.
(3)增大 B 的转化率,可采取的措施是_____(用序号填空)
①加入 A ②加入 B ③加压④再加入 1.6mol A+0.8mol B ⑤将 C 分离出容器
(4)若在相同条件下,在上述容器中充入 1.5mol C 和 0.5mol D 发生上述反应,为使平衡后,C 的浓度仍为 1.2mol/L,则应再充入_____molA 和_____molB.
(5)若在一体积可变的容器中,该反应达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况如下图,a 点改变的条件可能是_____;b 点改变的条件可能是_____;若升高温度时,请将反应速率变化情况画在 c-d 处。_____________

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com