
【题目】实验室用密度为1.18g/mL,质量分数为36.5%的浓盐酸配制240 mL 0.1mol/L的盐酸溶液。
(1)配制240mL 0.1mol/L的盐酸溶液,应取浓盐酸的体积为_______mL。
(2)所需玻璃仪器为______________________________________________。
(3)配制时,一般可分为以下几个步骤:①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却.其正确的操作顺序为:②→①→③→__→__→__→__→④(填序号)
(4)定容时往容量瓶中加蒸馏水到离刻度线1~2cm处改用胶头滴管加水至________________。
(5)实验中用到玻璃棒,其作用分别是:_____、_____。
(6)在配制过程中,下列操作引起所配溶液浓度偏低的有_____(填序号)
①定容时,俯视刻度线.
②未冷却至室温就转移到容量瓶中.
③容量瓶中含有少量蒸馏水.
④未洗涤稀释浓盐酸时用过的烧杯和玻璃棒.
⑤定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线.
⑥用量筒量取所需浓溶液时,仰视刻度.
【答案】 2.1 mL 250ml容量瓶 烧杯 玻璃棒 胶头滴管 量筒 ⑧⑤⑥⑦ 凹液面的最低点与刻度线相切 搅拌、引流 ④⑤
【解析】试题分析:密度为1.18g/mL、质量分数为36.5%的浓盐酸的物质的量浓度为11.8mol/L,实验室用此浓盐酸配制240 mL 0.1mol/L的盐酸溶液,因为没有240mL规格的容量瓶,需要用250mL的容量瓶配制250mL溶液,由稀释定律可求出需要量取浓盐酸的体积为![]() 2.1mL。
2.1mL。
(1)配制240mL 0.1mol/L的盐酸溶液,应取浓盐酸的体积为2.1mL。
(2)所需玻璃仪器为250ml容量瓶、烧杯、玻璃棒、胶头滴管、量筒等。
(3)配制时,一般可分为以下几个步骤:计算、量取、稀释、冷却、转移、洗涤、定容,所以正确的操作顺序为:②→①→③→⑧→⑤→⑥→⑦→④。
(4)定容时往容量瓶中加蒸馏水到离刻度线1~2cm处改用胶头滴管加水至凹液面的最低点与刻度线相切。
(5)实验中用到玻璃棒,其作用分别是:稀释浓盐酸时搅拌、转移溶液时引流。
(6)误差分析:①定容时,俯视刻度线,所配溶液体积偏小,则浓度偏高.②未冷却至室温就转移到容量瓶中,所配溶液体积偏小,浓度偏高.③容量瓶中含有少量蒸馏水,对所配溶液无影响.④未洗涤稀释浓盐酸时用过的烧杯和玻璃棒,则溶液浓度偏小.⑤定容、摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线,则所配溶液体积偏大,浓度偏小.⑥用量筒量取所需浓溶液时,仰视刻度,则量取的浓盐酸体积偏大,所配溶液浓度偏高.所以在配制过程中,引起所配溶液浓度偏低的操作有④⑤。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D四种可溶性盐,阳离子分别可能是Ba2+、Na+、Ag+、Cu2+中的某一种,阴离子分别可能是NO![]() 、SO
、SO![]() 、Cl-、CO
、Cl-、CO![]() 中的某一种。把四种盐分别溶于盛有蒸馏水的试管中,只有C盐的溶液呈蓝色。
中的某一种。把四种盐分别溶于盛有蒸馏水的试管中,只有C盐的溶液呈蓝色。
(1)向这四种盐溶液中分别加盐酸,B盐有沉淀产生,D盐有无色无味气体逸出。则它们的化学式应为:A________,B________,C________,D________。
(2)写出下列反应的离子方程式
①A+C_______________________________________________________。
②D+盐酸______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、H3AsO4、H2O和一种未知物质X.
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是_____。
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为:_____。
(3)根据上述反应可推知_____。
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:ASH3>X d.还原性:X>ASH3
(4)根据上述条件写出化学方程式__________________。
(5)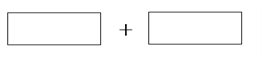 将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,用单线桥表示电子转移:_______________。
将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,用单线桥表示电子转移:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式或电离方程式书写正确的是
A. NaHCO3电离:NaHCO3![]() Na+ + H+ + CO32-
Na+ + H+ + CO32-
B. FeBr2与Cl2物质的量之比1:1反应:2Fe2+ + 4Br- + 3Cl2 = 2Fe3+ + 2Br2 + 6Cl-
C. 向稀NaHSO4溶液中滴加Ba(OH)2溶液至恰好沉淀达到最大量:HSO4- + Ba2+ + OH- = BaSO4↓ + H2O
D. 向漂白粉溶液中通入过量SO2气体:2H2O + Ca2+ + 2ClO- + 2SO2 = CaSO4↓+ 2Cl- + 4H+ + SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于 CO和CO2说法正确的是
A. 质量相等时,分子数之比7∶11
B. 同温同压下,密度之比7∶11
C. 物质的量相同时,体积之比1∶1
D. 原子数相同时,物质的量之比2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《物质结构与性质》
(1)下列粒子的立体构型不是平面三角形的是___________。
A.CO32- B.NH3 C.BF3 D.SO3
(2)下列分子中,属于含极性键的非极性分子的是___________。
A.CH4 B.H2S C.C60 D.HCl
(3)现有四种离子晶体的晶胞,其离子排列方式如下列图所示,其中化学式不属于Mn型的是______。

(4)联合制碱法又称侯氏制碱法,其原理为:第一步NaCl+ NH3 + CO2+H2O=NaHCO3 + NH4Cl,第二步加热NaHCO3使其分解。关于第一步反应所包含的各物质中:
①属于离子化合物的是_________________(填化学式);
②中心原子是sp杂化的分子是_________________(填化学式);
③NaCl晶体中Na+的配位数为___________;
④写出H2O的任意一种等电子体的化学式___________。
(5)周期表前四周期的五种元素a、b、c、d、e,其核电荷数依次增大。a原子的核外电子总数与其周期数相同,b原子的最外层电子中有3个未成对电子,c原子的最外层电子数是其内层电子数的3倍,d与c同主族,e的价电子排布为3d104s1。
①b、c元素的第一电离能大小为:b _______c(填“>"或“<”)
②d的基态原子的电子排布式为___________; a2d的VSKPK模型为___________。
③ba3和a2c两种分子键角较大的是___________;ba3极易溶于a2c的原因,除了两种分子都是极性
分子外,还因为____________________________。
④e和c能形成一种化合物,其晶胞结构如右图所示,若设阿伏伽德罗常数值为NA,晶体的密度为d g/cm3,则晶胞参数a= _______nm(用含d、NA的代数式表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com