
【题目】雾霾严重危害人类健康和生态环境,开发稳定高效的脱硫脱硝工艺是当前国内外研究的热点。
(1)天然气中含有的微量 H2S 会腐蚀管道和设备,可在 1200℃下进行脱硫处理,H2S 会被氧气氧化为SO2,并产生水蒸气。
化学键 | H-S | O=O | H-O | SO2 中共价键 |
键能/(kJmol-1) | 339 | 498 | 464 | 1083 |
请写出该反应的热化学方程式:______。
(2)利用 NaClO2/H2O2 酸性复合吸收剂可同时有效脱硫、脱硝,将 NO、SO2 氧化为硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)、溶液 pH 对脱硫脱硝的影响如图所示:
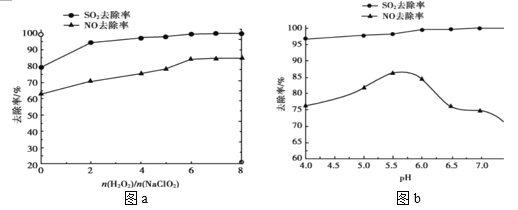
①从图 a 和图 b 中可知脱硫脱硝最佳 n(H2O2)/n(NaClO2)是_______、最佳 pH 是______。
②图 b 中 SO2 的去除率随 pH 的增大而增大,而 NO 的去除率在 pH>5.5 时反而减小,请解释 NO 去除率减小的可能原因是______。
(3)臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为 2NO2(g)+O3(g)N2O5(g)+O2(g),不同温度下,在体积为 1L 的甲、乙两个恒容密闭容器中均充入 l mol O3 和 2 mol NO2,相关信息如图所示,请回答下列问题:

①0~15min 内乙容器中反应的平均速率:v(NO2) =______。(保留 2 位有效数字)
②下列措施能提高容器乙中 NO2 转化率的是________(填字母标号)
A.向容器中充入氦气,增大容器的压强
B.升高容器的温度
C.向容器中再充人一定量的 NO2
D.向容器中再充入 l mol O3 和 2 mol NO2
③甲容器的初始压强为 p0,计算该反应的平衡常数 Kp=______。(分压=总压×物质的量分数)
(4)过二硫酸钾(K2S2O8)可作为燃煤锅炉脱硝的氧化剂。实验室通过电解饱和 KHSO4 溶液制备 K2S2O8。电解装置如图所示:

①电极 B 为______极(“阳”或“阴”)。
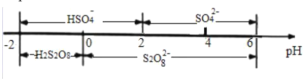
②在常温下,电解液中的含硫微粒的主要存在形式与 pH 的关系如图所示,将电极 A 区域的 pH 控制在 0~2 之间进行电解,则电极 A 的电极反应方程式为______。
【答案】2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H= -1172 kJmol-1 6:1 5.5~6.0 之间的任意值均可 pH>5.5 以后,随着 pH 增大,NO 的还原性降低;或 H2O2 和 NaClO2 氧化性减弱,不能将 NO 氧化为硝酸 0.053 mol·L-1·min-1 D 1.5/p0 阴 2HSO4--2e-=2S2O82-+2H+
【解析】
(1)H2S与O2的反应的方程式为2H2S+3O2=2SO2+2H2O,△H =反应物键能-生成物键能=4×339 kJmol-1+3×498 kJmol-1-(2×1083 kJmol-1+4×464 kJmol-1)=-1172 kJmol-1,所以热化学反应方程式为2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H= -1172 kJmol-1;
(2)①从图a和图b中可知,![]() =6:1,pH在5.5~6.0时NO、SO2的去除率最高,故脱硫、脱硝的最佳条件是
=6:1,pH在5.5~6.0时NO、SO2的去除率最高,故脱硫、脱硝的最佳条件是![]() =6:1,pH在5.5~6.0之间;
=6:1,pH在5.5~6.0之间;
②图b中SO2的去除率随pH的增大而增大,pH>5.5后,随着pH增大,NO的还原性降低(或NaClO2和H2O2氧化性减弱),NO不能被氧化成硝酸,故NO的去除率在pH>5.5时反而减小;
(3)①据图可知15min时容器中c(N2O5)=0.4mol/L,容器体积为1L,则初始时c(O3)=1mol/L,c(NO2)=2mol/L,列三段式:
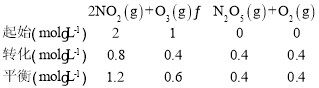
所以v(NO2)=![]() = 0.053 mol·L-1·min-1;
= 0.053 mol·L-1·min-1;
②提高容器乙中NO2转化率,即采取措施使反应2NO2(g)+O3(g)N2O5(g)+O2(g)向右进行的程度更大,温度甲<乙,平衡时正向程度甲>乙,表明正反应为放热反应,反应为气体分子数减少的反应,增大压强有利于反应正向进行,据此逐项分析,
A.恒容容器充入He,He不参与反应,充入He不改变气体各组分分压,不影响化学平衡,因此不能提高NO2转化率,故A不选;
B.反应为放热反应,升高温度不利于反应正向进行,不能提高NO2转化率,故B不选;
C.向容器中再充入一定量的NO2会使O3转化率升高,自身转化率降低,故C不选;
D.向容器中再充入lmol O3和2mo NO2,由于是按化学计量比充入,相当于对原平衡加压,则有利于反应正向进行,NO2平衡转化率增大,故D可选;
③初始气体总物质的量为1mol+2mol=3mol,平衡时甲容器中c(N2O5)=0.5mol/L,列三段式:
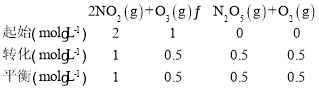
容器体积为1L,则平衡时气体总物质的量为1mol+0.5mol+0.5mol+0.5mol=2.5mol,则此时容器内压强为![]() ;则p(NO2)=
;则p(NO2)=![]() , p(O3)=p(N2O5)=p(O2)=
, p(O3)=p(N2O5)=p(O2)=![]() ,所以Kp=
,所以Kp=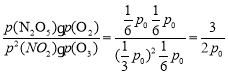 ;
;
(4)①K2S2O8中含有化合价为-1价的氧原子,所以KHSO
②据图可知pH在 0~2 之间时HSO4-并未电离,产物应为S2O82-,电极A为阴极得电子发生还原反应,所以电极方程式为2HSO4--2e-=2S2O82-+2H+。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有几组物质的熔点(℃)的数据:
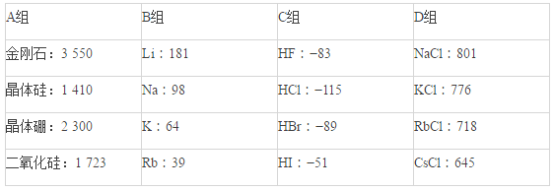
据此回答下列问题:
(1)A组属于___________晶体,其熔化时克服的微粒间的作用力是__________________。
(2)B组晶体共同的物理性质是___________________(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于_______________________________________。
(4)D组晶体可能具有的性质是_________________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因解释为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸乙酯是重要的精细化工试剂,常用于配制水果型食用香精。实验室制备流程如下:
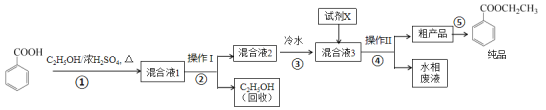
试剂相关性质如下表:
苯甲酸 | 乙醇 | 苯甲酸乙酯 | |
常温性状 | 白色针状晶体 | 无色液体 | 无色透明液体 |
沸点/℃ | 249.0 | 78.0 | 212.6 |
相对分子量 | 122 | 46 | 150 |
溶解性 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 | 与水任意比互溶 | 难溶于冷水,微溶于热水,易溶于乙醇和乙醚 |
回答下列问题:
(1)为提高原料苯甲酸的纯度,可采用的纯化方法为_________。
(2)步骤①的装置如图所示(加热和夹持装置已略去),将一小团棉花放入仪器B中靠近活塞孔处,将吸水剂(无水硫酸铜的乙醇饱和溶液)放入仪器B中,在仪器C中加入 12.2 g纯化后的苯甲酸晶体,30 mL无水乙醇(约0.5 mol)和3 mL浓硫酸,加入沸石,加热至微沸,回流反应1.5~2 h。仪器A的作用是_________;仪器C中反应液应采用_________方式加热。
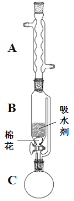
(3)随着反应进行,反应体系中水分不断被有效分离,仪器B中吸水剂的现象为_________。
(4)反应结束后,对C中混合液进行分离提纯,操作I是_________;操作II所用的玻璃仪器除了烧杯外还有_________。
(5)反应结束后,步骤③中将反应液倒入冷水的目的除了溶解乙醇外,还有_____;加入试剂X为_____(填写化学式)。
(6)最终得到产物纯品12.0 g,实验产率为_________ %(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 资源化利用能有效减少碳排放,充分利用碳资源。
资源化利用能有效减少碳排放,充分利用碳资源。
(1)光电催化实现![]() 资源化利用的原理如图:
资源化利用的原理如图:
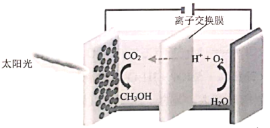
①写出阴极![]() 还原为
还原为![]() 的电极反应式:___________。
的电极反应式:___________。
②与直接电解法相比,生成等量的![]() 时,光电催化法消耗的电能更少。其原因是___________。
时,光电催化法消耗的电能更少。其原因是___________。
(2)![]() 催化加氢合成二甲醚过程中主要发生下列反应:
催化加氢合成二甲醚过程中主要发生下列反应:
反应Ⅰ:![]()
![]()
反应Ⅱ:![]()
![]()
①反应Ⅰ中的![]() 平衡转化率随温度升高而增大的原因是__________。
平衡转化率随温度升高而增大的原因是__________。
②在恒压、![]() 和
和![]() 的起始量一定的条件下,
的起始量一定的条件下,![]() 平衡转化率和平衡时
平衡转化率和平衡时![]() 的选择性(
的选择性(![]() 的选择性
的选择性![]() )随温度的变化如图:
)随温度的变化如图:

T℃时,起始投入![]() ,
,![]() ,达到平衡时反应Ⅰ理论上消耗
,达到平衡时反应Ⅰ理论上消耗![]() 的物质的量为_______。该催化剂条件下合成二甲醚时较适宜的温度为260℃,其原因是______________。
的物质的量为_______。该催化剂条件下合成二甲醚时较适宜的温度为260℃,其原因是______________。
(3)研究发现,(2)中的反应Ⅱ分两步完成,即发生反应Ⅲ和Ⅳ。
反应Ⅲ:![]()
![]()
反应Ⅳ:![]()
①反应Ⅳ的![]() ____
____![]()
②其他条件相同时,若两容器中分别仅发生反应Ⅱ和反应Ⅲ,测得反应Ⅱ中![]() 的平衡转化率更高,其原因可能是__________。
的平衡转化率更高,其原因可能是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国第二化工设计院提出,用间接电化学法对大气污染物 NO 进行无害化处理,其原理示意如图,下列相关判断正确的是
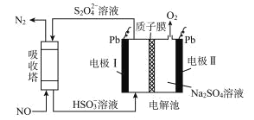
A.电极 I为阴极,电极反应式为 2H2O+2e-=2OH-+H2↑
B.电解池中质子从电极 I 向电极Ⅱ作定向移动
C.每处理 1 mol NO 电解池右侧质量减少 16 g
D.吸收塔中的反应为 2NO+2S2O42-+H2O=N2+4HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H的分子中含有醛基和酯基。H可以用C和F在一定条件下合成(如图):
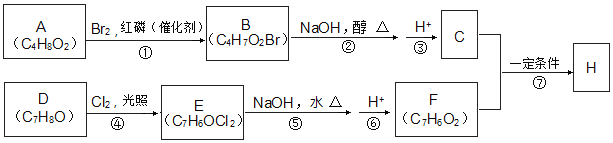
已知以下信息:
①A的核磁共振氢谱中有三组峰;且能与饱和碳酸氢钠溶液反应放出CO2。
②RCH2COOH 。
。
③化合物D苯环上的一氯代物只有两种。
④通常同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
(1)A的名称为___。
(2)D的官能团名称为___。
(3)反应②的化学方程式为__,⑦的反应类型为___。
(4)F的结构简式为__。
(5)H在一定条件下反应生成高聚物的化学方程式为___。
(6)F的同系物G比F相对分子质量大14,G的同分异构体中能同时满足如下条件:
①苯环上只有两个取代基;②不能使FeCl3溶液显色,共有__种(不考虑立体异构)。其中能与碳酸氢钠溶液反应且核磁共振氢谱为4组峰,且峰面积比为3:2:2:1,写出G的这种同分异构体的结构简式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度较小;另一种为黄绿色,在水中的溶解度较大。
(1)PtCl2(NH3)2为__________结构(填“平面四边形”或“四面体”)。
(2)黄绿色固体的立体构型图为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1 mol·L-1 NaOH溶液滴定40 mL 0.1 mol·L-1 H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述错误的是( )
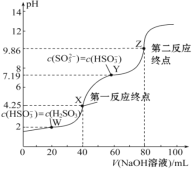
A. Ka2(H2SO3)的数量级为10-8
B. 若滴定到第一反应终点,可用甲基橙作指示剂
C. 图中Z点对应的溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)
D. 图中Y点对应的溶液中:3c(SO32-)=c(Na+)+c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取Cu、Cu2O和CuO固体混合物,将其分成两等份,一份用足量的氢气还原,反应后固体质量减少6.40g,另一份加入1000mL稀硝酸,固体恰好完全溶解,收集到标准状况下NO气体4.48L,所用硝酸的物质的量浓度为
A. 3.2mol/L B. 1.6mol/L C. 0.9mol/L D. 无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com