
【题目】I.现有下列物质①100 ℃纯水②25 ℃ 0.1 mol/L HCl溶液③25 ℃ 0.1 mol/L KOH溶液④25 ℃ 0.1 mol/L Ba(OH)2溶液。
(1)这些物质与25 ℃纯水相比,能促进水电离的是________(填序号,下同),能抑制水的电离的是________,水电离的c(OH-)等于溶液中c(OH-)的是________,水电离的c(H+)等于溶液中c(H+)的是________。
(2)②和③溶液中水的电离度相等,进而可推出的结论是:同一温度下,___________时,水的电离度相等。
II.今有①盐酸②醋酸③硫酸三种稀溶液,用序号回答下列问题。
(1)若三种酸的物质的量浓度相等,三种溶液中的c(H+)大小关系为______
(2)若三种溶液的c(H+)相等,三种酸的物质的量浓度大小关系为_____。
【答案】① ②③④ ①② ③④ 酸溶液中的![]() 与碱溶液中的
与碱溶液中的![]() 相等时 ③>①>② ②>①>③
相等时 ③>①>② ②>①>③
【解析】
一定温度下,水存在电离平衡H2O(l)H+(aq)+OH-(aq)△H>0,升高温度或加入能与H+或OH-反应的离子,可促进水的电离,如加入酸或碱,溶液中H+或OH-浓度增大,则抑制水的电离,以此解答该题。
I.(1) ①100 ℃纯水②25 ℃ 0.1 mol/L HCl溶液③25 ℃ 0.1 mol/L KOH溶液④25 ℃ 0.1 mol/L Ba(OH)2溶液;一定温度下,水存在电离平衡H2O(l)H+(aq)+OH-(aq)△H>0,这些物质与25℃纯水相比,能促进水的电离的是升高温度,因水的电离为吸热反应;
加入酸、碱溶液可抑制水的电离,即②③④抑制水的电离;水电离的![]() 水等于溶液中
水等于溶液中![]() ,可为中性溶液或酸溶液,如纯水、盐酸等,①②符合;水电离的
,可为中性溶液或酸溶液,如纯水、盐酸等,①②符合;水电离的![]() 水等于溶液中
水等于溶液中![]() ,可为中性溶液或碱溶液,如纯水、氢氧化钾、氢氧化钡溶液,①③④符合;
,可为中性溶液或碱溶液,如纯水、氢氧化钾、氢氧化钡溶液,①③④符合;
故答案为:①;②③④;①②;①③④;
(2)纯水中加入酸、碱,可抑制水的电离;从②和③溶液中水的电离程度相等,进而可推出的结论是:同一温度下酸溶液中的![]() 等于碱溶液中的
等于碱溶液中的![]() ,水的电离程度相等;
,水的电离程度相等;
故答案为:酸溶液中的![]() 与碱溶液中的
与碱溶液中的![]() 相等时;
相等时;
II.(1)今有①盐酸②醋酸③硫酸三种稀溶液,若三种酸的物质的量浓度相等为a,则硫酸中氢离子的浓度为2a,盐酸中氢离子的浓度为a,醋酸不完全电离,氢离子的浓度小于a,则三种溶液中的c(H+)大小关系为③>①>②;
(2)若三种溶液的c(H+)相等,则三种酸的物质的量浓度大小关系与(1)相反:②>①>③。


科目:高中化学 来源: 题型:
【题目】已知在25℃,101kPa下,lg C8H18(辛烷)(相对分子质量:114)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是( )
A. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(g);△H=-48.40kJ·mol-1
B. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ·mol-1
C. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=+5518kJ·mol-1
D. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=-48.40kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气的脱硫脱硝是目前研究的热点。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJmol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJmol-1
③H2O(g)=H2O(l) △H=-44 kJmol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l) 的热化学方程式_________。
(2)某科研小组研究臭氧氧化--碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+ O3(g) NO2(g)+O2(g) △H1= -200.9 kJmol-1Ea1= 3.2 kJmol-1
反应Ⅱ:SO2(g)+ O3(g) SO3(g)+O2(g)△H2= -241.6 kJmol-1 Ea2= 58 kJmol-1
已知该体系中臭氧发生分解反应:2O3(g) 3O2(g)。请回答:
其它条件不变,每次向容积为2L的反应器中充入含1.0 mol NO、1.0 mol SO2的模拟烟气和2.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:
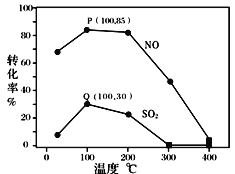
①由图可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_______。
②下列说法正确的是 ____________ 。
A.P点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若缩小反应器的容积可提高NO和SO2的转化率
③假设100℃时P(NO转化率为85%)、Q(SO2转化率为30%)均为平衡点,此时反应时间为10分钟,发生分解反应的臭氧占充入臭氧总量的10%,则体系中剩余O3的物质的量是_______mol;NO的平均反应速率为_______________;反应Ⅱ在此时的平衡常数为_______________ 。
(3)用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能:
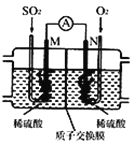
①M极发生的电极反应式为 ____________。
②当外电路通过0.2 mol电子时,质子交换膜左侧的溶液质量_____(填“增大”或“减小”)_______克。
查看答案和解析>>
科目:高中化学 来源: 题型:
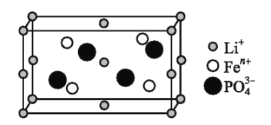
【题目】锂的某些化合物是性能优异的材料。请回答:
(1)如图是某电动汽车电池正极材料的晶胞结构示意图,其化学式为 ______ ,其中![]() 的基态电子排布式为 ______ ,
的基态电子排布式为 ______ ,![]() 的空间构型为 ______ 。
的空间构型为 ______ 。
(2)![]() 与Na中第一电离能较小的元素是 ______ ;LiF与NaCl晶体中熔点较高的是 ______ 。
与Na中第一电离能较小的元素是 ______ ;LiF与NaCl晶体中熔点较高的是 ______ 。
(3)氮化锂是一种良好的储氢材料,其在氢气中加热时可吸收氢气得到氨基锂![]() 和氢化锂,氢化锂的电子式为 ______ ,上述反应的化学方程式为 ______。
和氢化锂,氢化锂的电子式为 ______ ,上述反应的化学方程式为 ______。
(4)金属锂为体心立方晶胞,其配位数为 ______ ;若其晶胞边长为apm,则锂晶体中原子的空间占有率是 ______ 。
(5)有机锂试剂在有机合成中有重要应用,但极易与![]() 、
、![]() 等反应.下列说法不正确的是 ______
等反应.下列说法不正确的是 ______ ![]() 填字母序号
填字母序号![]() 。
。
A.CO2中σ键与π键的数目比为1:1
B.游离态和化合态锂元素均可由特征发射光谱检出
C.叔丁基锂(C4H9Li)中碳原子的杂化轨道类型为sp3和sp2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)材料是人类赖以生存的物质基础。
①制造水泥、玻璃都要用到的原料是___(填字母)。
a.石灰石 b.纯碱 c.黏土
②不锈钢丝与棉纤维可织成一种防辐射布料。这种布料属于___(填字母)。
a.合金材料 b.复合材料 c.陶瓷材料
③橡胶可用于制造轮胎,天然橡胶通过___(填字母)措施可增大强度和弹性。
a.硝化 b.氧化 c.硫化
(2)环境保护功在当代、利在千秋。
①燃煤中加入碳酸钙,可减少SO2的排放。表示该反应原理的化学方程式为___。
②治理废水中的重金属污染物可用沉淀法。往含铬(Cr3+)废水中加入石灰乳使Cr3+转变为___(填化学式)沉淀而除去。
③将CO2和H2按物质的量1∶4混合,在Ru/TiO2作催化剂、加热条件下反应可获得CH4。写出该反应的化学方程式:___。
(3)合理选择饮食,有益身体健康。某同学在食堂的午餐是:米饭、红烧肉、西红柿炒鸡蛋和一只苹果。
①其中主要为人体提供能量的食物是___。该食物中的主要成分在人体内完全水解的化学方程式为___。
②西红柿中富含维生素C,西红柿生吃比炒熟后吃维生素C的利用率高,原因是___。用淀粉溶液和碘水检验维生素C的还原性,有关实验操作和现象是___。
③苹果中含有一定量的铁元素,人体缺铁会导致的疾病是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲探究FeSO4溶液与浓HNO3的反应。
该同学向盛有FeSO4溶液的试管中滴入数滴浓硝酸,并振荡试管,预期现象为试管中会立即产生红棕色气体,溶液焰色逐渐变黄。但实际操作时观察到液面上方气体变化红棕色,且试管中溶液颜色变为深棕色。
为了进一步探究溶液变为深棕色的原因,该同学进行如下实验。
回答下列问题
(1)向FeSO4溶液和反应后溶液中加入KSCN溶液,前者不变红色,后者变红,该现象的结论是________。
(2)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的。为此他利用如图装置(气密性已检验,尾气处理装备略)进行探究。
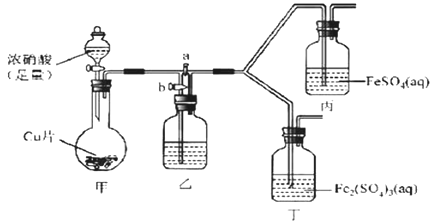
Ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化。
Ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应。
Ⅲ.为与Ⅰ中实验进行对照重新更换丙、丁后,使甲中反应重复进行步骤Ⅰ实验,观察到的现象与步骤Ⅰ中相同。
①铜与足量浓硝酸反应的离子方程式是_______________。
②装置乙的试剂为____________________。
③步骤Ⅱ的目的是_______________________。
④该实验可得出的结论是______________________。
(3)该同学重新进行FeSO4溶液与浓HNO3的反应的实验,观察到了预期现象,其实验操作是_________,反应的离子方程式为___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某学生为探究AgCl沉淀转化为![]() 沉淀的反应所做实验的记录.
沉淀的反应所做实验的记录.
步骤 | 现象 |
Ⅰ | 立即产生白色沉淀 |
Ⅱ | 沉淀迅速变为黑色 |
Ⅲ | 较长时间后,沉淀变为乳白色 |
Ⅳ | 产生红棕色气体,沉淀部分溶解 |
Ⅴ | 产生白色沉淀 |
![]() 为了证明沉淀变黑是AgCl转化为
为了证明沉淀变黑是AgCl转化为![]() 的缘故,步骤I中NaCl溶液的体积范围为 ______ 。
的缘故,步骤I中NaCl溶液的体积范围为 ______ 。
![]() 已知:
已知:![]() 时
时![]() ,
,![]() ,此沉淀转化反应的平衡常数
,此沉淀转化反应的平衡常数![]() ______。
______。
![]() 步骤V中产生的白色沉淀的化学式为 ______ ,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有 ______。
步骤V中产生的白色沉淀的化学式为 ______ ,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有 ______。
![]() 为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置。
为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置。
![]() 装置A中玻璃仪器有圆底烧瓶、导管和 ______ ,试剂W为 ______ 。
装置A中玻璃仪器有圆底烧瓶、导管和 ______ ,试剂W为 ______ 。
![]() 装置C中的试剂为NaCl溶液和
装置C中的试剂为NaCl溶液和![]() 悬浊液的混合物,B中试剂为 ______ 。
悬浊液的混合物,B中试剂为 ______ 。
![]() 实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化。
实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化。
完成C中反应的化学方程式:______Ag2S+_____NaCl+______ + ______ AgCl+S+ ______
______
C中NaCl的作用是: ______ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在新材料、工农业生产等方面用途很广。请回答下列问题:
![]() 元素的基态原子的价电子排布图为______,B、N、O元素的第一电离能由大到小的顺序为______。
元素的基态原子的价电子排布图为______,B、N、O元素的第一电离能由大到小的顺序为______。
![]() 三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性气味的无色有毒腐蚀性气体,其分子的立体构型为______,B原子的杂化类型为______。
三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性气味的无色有毒腐蚀性气体,其分子的立体构型为______,B原子的杂化类型为______。
![]() 自然界中,含B的钠盐是一种天然矿藏,其化学式写作
自然界中,含B的钠盐是一种天然矿藏,其化学式写作![]() ,实际上它的阴离子结构单元是由两个
,实际上它的阴离子结构单元是由两个![]() 和两个
和两个![]() 缩合而成的双六元环,应该写成
缩合而成的双六元环,应该写成![]() ,其结构式如图1,它的阴离子可形成链状结构。该阴离子由极性键和配位键构成,请在答题卷中抄上图1结构式后用“
,其结构式如图1,它的阴离子可形成链状结构。该阴离子由极性键和配位键构成,请在答题卷中抄上图1结构式后用“![]() ”标出其中的配位键,该阴离子通过______相互结合形成链状结构。
”标出其中的配位键,该阴离子通过______相互结合形成链状结构。

![]() 科学家发现硼化镁在39K时有超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图2是该晶体微观结构中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影。则硼化镁的化学式为______。
科学家发现硼化镁在39K时有超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图2是该晶体微观结构中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影。则硼化镁的化学式为______。
![]() 磷化硼
磷化硼![]() 是一种有价值的超硬耐磨涂层材料,这种陶瓷材料可作为金属表面的保护薄膜。磷化硼晶胞如图3所示,在BP晶胞中B的堆积方式为______,当晶胞晶格参数为478pm时,磷化硼中硼原子和磷原子之间的最近距离为______cm。
是一种有价值的超硬耐磨涂层材料,这种陶瓷材料可作为金属表面的保护薄膜。磷化硼晶胞如图3所示,在BP晶胞中B的堆积方式为______,当晶胞晶格参数为478pm时,磷化硼中硼原子和磷原子之间的最近距离为______cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下体积均为2L的两个恒容容器中发生可逆反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-196kJ·mol-1,实验测得有关数据如下表:
2SO3(g) △H=-196kJ·mol-1,实验测得有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
SO2 | O2 | SO3 | ||
① | 2 | 1 | 0 | 放热 156.8 kJ |
② | 0.6 | 0.3 | 1.4 | Q(Q>0) |
下列叙述不正确的是
A. 容器①中达到平衡吋,O2的转化率为80%
B. Q=19.6kJ
C. 容器①、②中反应的平衡常数相等,K=80
D. 相同温度下,起始时向容器中充入0.8 mol SO2、0.4 mol O2和3.2 mol SO3,反应达到平衡前v(正)>v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com